
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
B.常温下![]() =12的溶液:Fe2+、Mg2+、NO3-、Cl-
=12的溶液:Fe2+、Mg2+、NO3-、Cl-
C.含有大量Al3+的溶液中:Na+、Cl-、AlO2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32-
科目:高中化学 来源: 题型:
【题目】在密闭容器里,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示,已知3v(B)=2v(A)、2v(C)=3v(B),则此反应可表示为
A. 2A+3B = 2C B. A+3B = 2C C. 3A+2B = 3C D. A+B = C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L某混合溶液中,溶质X、Y浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.lmol/L氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
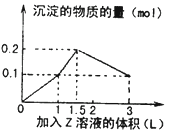
A.氯化铝、氯化铁、氢氧化钠 B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸 D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
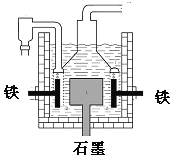
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)=4Na+O2↑+2H2O;后来盖· 吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是( )
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:Na++e-=Na
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数比为2:l
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上食用油的生产大多数采用浸出工艺。菜籽油的生产过程为:将菜籽压成薄片,用轻汽油浸泡,进行操作A;过滤,得液体混合物;对该混合物进行操作B,制成半成品油,再经过脱胶、脱色、脱臭即制成食用油。操作A和B的名称分别是
A.溶解、蒸发 B.萃取、蒸馏 C.分液、蒸馏 D.萃取、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程可用下图表示:
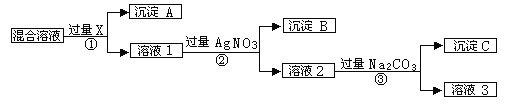
请回答下列问题:
(1)上述实验流程中①②③充分反应后进行物质的分离操作时所需玻璃仪器有 ;
(2)上述实验流程中试剂X为 ,溶液3所含溶质 (均用化学式表示);
(3)上述实验流程中加入过量的Na2CO3的目的是 。
(4)写出上述流程各步所涉及到的化学方程式:
① ②
(5)简述检验溶液1中是否含有SO42-实验操作方法 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺流程如下:
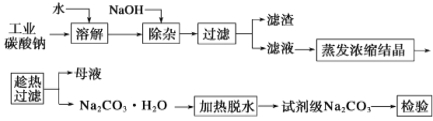
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
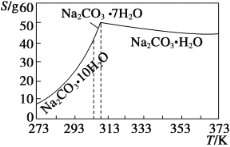
回答下列问题:
(1)滤渣的主要成分为_____________________________。
(2)“趁热过滤”的原因是_________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是________(写出一种)。
(4)已知:Na2CO3·10H2O (s)===Na2CO3(s)+10H2O(g) ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、c均能与稀硫酸反应放出气体;②b与d的硝酸盐反应,置换出单质d;③c与强碱反应放出气体;④c、e在冷的浓硝酸中发生钝化。由此判断:a、b、c、d、e分别是( )
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制物质的量浓度为0.1 mol/L的Na2CO3溶液l00mL时,下列操作正确的是( )
A. 用托盘天平称取l.06g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B. 定容时,若仰视,则所配溶液的浓度将偏高
C. 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D. 在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com