
| A. | 各电解池析出气体体积总数的变化 | B. | 各电解池阳极质量的增加 | ||
| C. | 各电解池阴极质量的增加 | D. | 各电极上放电的离子总数的变化 |
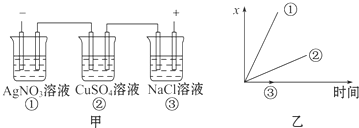
分析 电解NaCl溶液时阴、阳极都产生气体,电解AgNO3溶液时阴极上产生单质银,电解CuSO4溶液时阴极上产生单质铜,所以随着电解的进行,阴极质量的增加量有如题中图乙所示的变化.
解答 解:A.电解硝酸银和硫酸铜,阳极都生成氧气,体积应相等,故A错误;
B.电解硝酸银和硫酸铜,阳极都生成氧气,阳极质量不变,故B错误;
C.电解AgNO3溶液时阴极上产生单质银,电解CuSO4溶液时阴极上产生单质铜,银的质量增加量较大,而电解NaCl溶液时阴、阳极都产生气体,阳极质量不变,故C正确;
D.各电极上放电的离子总数应相等,故D错误.
故选C.
点评 本题考查电解原理,为高频考点,明确离子放电顺序及各个电极上发生的反应是解本题关键,会正确书写各个电极反应式,题目难度不大.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 四种元素的单质中,Z单质的熔沸点最高 | |
| D. | X的单质能与H2反应,生成一种弱酸性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
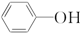 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子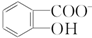 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是 中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.1 mol•L-1 | C. | 2.0 mol•L-1 | D. | 1.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
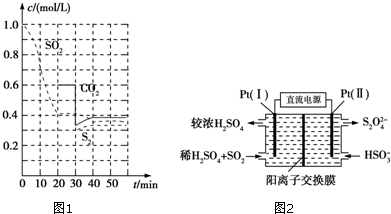
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com