
| A. | 氨常用作制冷剂,是因为其沸点较高,很容易液化 | |
| B. | 常温下氨水与铁不反应,因此氨水可盛放在铁桶里 | |
| C. | 用热的纯碱溶液洗去油污,是因为纯碱可以增强油污的挥发性 | |
| D. | 氯气具有强氧化性,因此可漂白有色布料 |
分析 A.氨气易液化,且在气化时会吸收大量热,所以液氨常用作制冷剂;
B.氨水呈碱性,是电解质溶液;
C.油污主要成分是酯类,在碱性溶液中发生水解生成溶于水的醇和酸;
D.氯气和水反应生成的次氯酸具有漂白作用.
解答 解:A.氨易液化,在液态氨汽化时要吸收大量的热,使周围的温度急剧下降,所以液氨常用作制冷剂,故A正确;
B.氨水呈碱性,铁在碱性或酸性环境下容易发生电化学腐蚀,故B错误;
C.油污主要成分是酯类,在碱性溶液中发生水解生成溶于水的醇和酸,不是增强油污的挥发性,故C错误;
D.氯气和水反应生成的次氯酸具有漂白作用,氯气本身无漂白作用,故D错误.
故选A.
点评 本题主要考查物质的性质、组成以及用途,题目难度不大,掌握物质性质是解题关键.


科目:高中化学 来源: 题型:解答题
 .
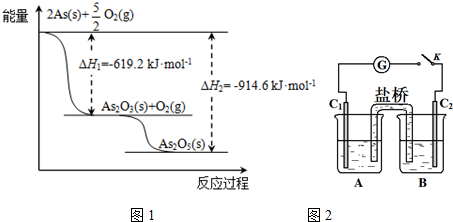
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2HPO3溶液显碱性,说明HPO32-的电离程度大于水解程度 | |
| B. | 25℃时,将0.1 mol•L-1的亚磷酸溶液加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| C. | 利用H3PO3进行化学镀银,当参加反应的$\frac{n(A{g}^{+})}{n({H}_{3}P{O}_{3})}$=2时,氧化产物为H3PO4 | |
| D. | NaH2PO3溶液显酸性,其溶液中存在的粒子浓度关系:c(H2PO3-)>c(HPO32-)>c(H3PO3)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
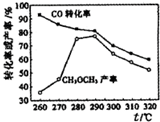 研究者在某条件下探究制备二甲醚反应:2CO(g)+4H2(g)?CH3 OCH3(g)+H2 O(g)△H,测定结果如图所示.下列判断错误的是( )
研究者在某条件下探究制备二甲醚反应:2CO(g)+4H2(g)?CH3 OCH3(g)+H2 O(g)△H,测定结果如图所示.下列判断错误的是( )| A. | △H<0 | |
| B. | 该反应伴随有副反应的发生 | |
| C. | 制备二甲醚的适宜温度为280~290℃ | |
| D. | 加入催化剂可以提高CH3 OCH3的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
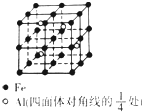 某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.
某宝石的主要成分是Al2O3,其中混有少量Mg、Ti、Fe等杂质而使其呈蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
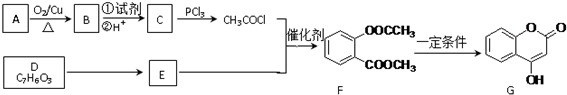
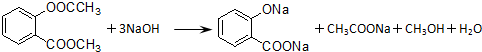 .
. .
.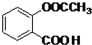 .
.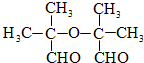 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
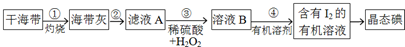
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M>N | B. | M=10-4N | C. | N=10-4M | D. | M=N |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:填空题
在四个脱落标签的试剂瓶中,分别盛有盐酸、Ba(OH)2溶液、NaHCO3溶液、Mg(NO3)2溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为A+B混合产生无色气体;B+C混合产生白色沉淀;C+D混合产生白色沉淀;A+C混合无明显变化。
(1)A+C反应的离子方程式为 。
(2)A+B反应的离子方程式为 。
(3) C +D反应的离子方程式为 。
(4)少量B+C反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com