
| A. | 往Na[Al(OH)4]溶液中通入过量CO22[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O | |
| B. | Na2SiO3溶液与稀醋酸混合SiO32-+2H+=H2SiO3↓ | |
| C. | 钠与CuSO4溶液反应2Na+Cu2+=Cu+2Na+ | |
| D. | 往Na2SO3溶液中滴加双氧水 H2O2+SO32-=SO42-+H2O |
分析 A.往Na[Al(OH)4]溶液中通入过量CO2,生成氢氧化铝沉淀和碳酸氢钠;
B.醋酸为弱酸,应写化学式;
C.钠先和水反应生成NaOH和氢气,生成的NaOH和CuSO4反应生成沉淀Cu(OH)2;
D.双氧水中-1价的氧具有氧化性,能氧化+4价的硫.
解答 解:A.二氧化碳过量,生成碳酸氢根离子,离子反应为:2[Al(OH)4]-+2CO2=2Al(OH)3↓+2HCO3-,故A错误;
B.乙酸酸性强于硅酸,Na2SiO3溶液与稀醋酸混合,两者发生复分解反应,离子反应为:SiO32-+2CH3COOH=H2SiO3↓+2CH3COO-,故B错误;
C.钠为活泼金属,钠与CuSO4溶液反应,钠先和水反应:2Na+2H2O═2NaOH+H2↑,生成的NaOH和CuSO4反应:2NaOH+CuSO4═Cu(OH)2↓+Na2SO4,离子反应为:Cu2++2Na+2H2O=Cu(OH)2↓+2Na++H2↑,故C错误;
D.往Na2SO3溶液中滴加双氧水,+4价的硫被氧化成+6价,发生的离子反应为:H2O2+SO32-=SO42-+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重于复分解反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
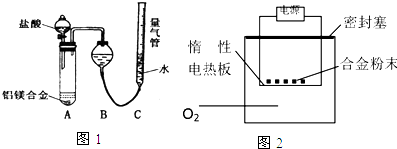
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
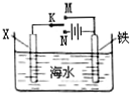
| A. | 若X为锌棒,开关K置于M处,可减缓铁的腐蚀 | |
| B. | 若X为锌棒,开关K置于M处,铁电极的反应:Fe-2e→Fe2+ | |
| C. | 若X为碳棒,开关K置于N处,可减缓铁的腐蚀 | |
| D. | 若X为碳棒,开关K置于N处,铁电极的反应:2H++2e→H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
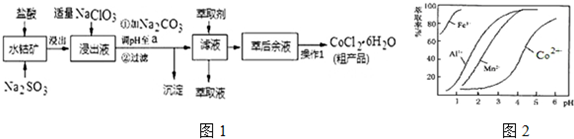
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
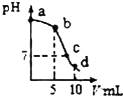 25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.
25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O+H2O═2NaOH | B. | Zn+H2SO4(稀)═ZnSO4+H2↑ | ||
| C. | 2AgNO3═2Ag+2NO2↑+O2↑ | D. | 3NO2+H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com