
分析 (1)元素化合价变化和电子守恒配平书写化学方程式,碘元素化合价+5价,-1价变化为0价;
(2)以淀粉为指示剂,逐滴加入物质的量浓度为2.000×10-3 mol/L的Na2S2O3溶液和碘单质反应,变蓝色的溶液颜色退去;
(3)依据化学方程式的定量关系计算,KIO3~3I2~6Na2S2O3;
(4)酸性环境下:2H++S2O32-=S↓+SO2↑+H2O,滴定前需要加入氢氧化钠溶液中和至中性,若不中和消耗Na2S2O3溶液体积增大,测定结果会增大.
解答 解:(1)碘元素化合价+5价,-1价变化为0价,电子转移总数为5,则KI前系数5,KIO3前系数1,结合原子守恒配平化学方程式为:KIO3+5 KI+3 H2SO4=3 K2SO4+3 I2+3H2O,
故答案为:1,5,3,3,3,3;
(2)以淀粉为指示剂,逐滴加入物质的量浓度为2.000×10-3 mol/L的Na2S2O3溶液和碘单质反应,I2+2S2O32-=2I-+S4O62-,变蓝色的溶液颜色退去变为无色,
故答案为:蓝;无;
(3)KIO3+5 KI+3 H2SO4=3 K2SO4+3 I2+3H2O,I2+2S2O32-=2I-+S4O62-,
I~KIO3~3I2~6Na2S2O3
1 6
n 2.000×10-3 mol/L×0.0150L
n=$\frac{2.000×1{0}^{-3}mol/L×0.0150L}{6}$=5.00×10-6mol
所测精制食盐中的碘含量是=$\frac{5.00×1{0}^{-6}mol×127g/mol}{Wg}$=$\frac{635}{W}$mg/kg,
故答案为:$\frac{635}{W}$;
(4)酸性环境下:2H++S2O32-=S↓+SO2↑+H2O,滴定前需要加入氢氧化钠溶液中和至中性,若不中和消耗Na2S2O3溶液体积增大,计算得到碘元素含量会偏高,
故答案为:先加适量NaOH中和多余硫酸至溶液中性;偏高.
点评 本题考查学生对实验设计、操作、实验结果分析的能力,主要是滴定实验的过程分析应用,实验基本操作,掌握基础是解题关键,题目难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 等质量的O2比O3能量低,由O2变O3为放热反应 | |
| B. | 等质量的O2比O3能量高,由O2变O3为吸热反应 | |
| C. | O3比O2稳定,由O2变O3为放热反应 | |
| D. | O2比O3稳定,由O2变O3为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:1 | C. | 2:3 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期ⅥB族;p区 | B. | 第三周期ⅢB族;ds区 | ||
| C. | 第四周期ⅥB族;d区 | D. | 第四周期ⅢB族;f区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水是电解质 | |
| B. | 氯化氢是电解质,所以液态氯化氢导电,气态氯化氢不导电 | |
| C. | CuSO4是电解质,CuSO4•5H2O不是电解质 | |
| D. | 蔗糖、乙醇等多数有机化合物和非金属氧化物都是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
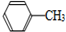 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$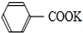 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O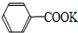 +HCl→
+HCl→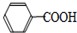 +KCl
+KCl
| A. | 上述反应原理的两个反应都是氧化还原反应 | |
| B. | 操作Ⅰ是蒸馏,操作Ⅱ是分液 | |
| C. | 无色液体A是甲苯,白色固体B主要成分是苯甲酸 | |
| D. | 无色液体A是苯甲酸,白色固体B主要成分是甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在进行焰色反应时,透过蓝色钴玻璃看到紫色火焰,证明含K+,不含Na+ | |
| B. | 向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ | |
| C. | 向某无色溶液中加入稀盐酸后,再加入AgNO3溶液,产生白色沉淀,证明含Clˉ | |
| D. | 向某无色溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体,证明含CO32ˉ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com