
| A、+1 | B、+2 | C、+3 | D、+4 |
| 0.003mol |
| 1×10-3mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、由分子构成的物质其熔点一般较低 |
| B、分子晶体在熔化时,共价键没有被破坏 |
| C、分子晶体中一定存在共价键 |
| D、分子晶体中分子间作用力越大,其化学性质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 |
| B、A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 |
| C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 |
| D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在吸热反应中,反应物的总能量比生成物的总能量高 |
| B、应用盖斯定律可以计算某些难以测量的反应焓变 |
| C、需要加热的化学反应都是吸热反应 |
| D、盐类的水解反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油、柴油和植物油都是碳氢化合物 |
| B、纤维素、淀粉、蛋白质在一定条件下都能发生水解反应 |
| C、石油的分馏和煤的干馏都是物理变化 |
| D、苯环内含有碳碳单键和碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、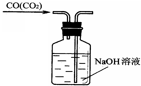 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
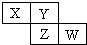 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、X的气态氢化物比Y的稳定 |
| B、X与Y形成的化合物都易溶于水 |
| C、Z的非金属性比Y的弱 |
| D、原子半径:X>Y>Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60 s内X的平均反应速率为0.001 mol?L-1?s-1 | ||
B、将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的
| ||
| C、若温度和体积不变,往容器内增加1 mol X,X的转化率将增大 | ||
| D、若升高温度,X的体积分数增大,则正反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com