
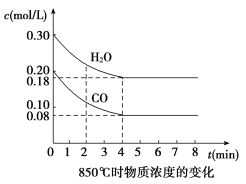
【题目】(1)在一体积为10 L的容器中,通入一定量的CO和H2O,在850 ℃时发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g);ΔH<0。CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=____ mol/(L·min)。
CO2(g)+H2(g);ΔH<0。CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=____ mol/(L·min)。
t1 ℃时物质浓度(mol/L)的变化
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(2)t1 ℃(高于850 ℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。请回答:
①表中3~4 min之间反应处于________状态;c1数值________0.08 mol/L(填大于、小于或等于)。
②反应在4~5 min间,平衡向逆方向移动,可能的原因是________(单选),表中5~6 min之间数值发生变化,可能的原因是________(单选)。
a.增加了水蒸气的量 b.降低温度
c.使用催化剂 d.增加氢气浓度
【答案】(1) 0.03 (2) ①平衡 大于 ②d a
【解析】(1)根据图像可知,在0~4 min内CO的浓度减小了0.20 mol/L-0.08 mol/L=0.12 mol/L,所以其反应速率是0.12 mol/L÷4 min=0.03 mol/(L·min)。(2)①根据表中数据可知,在此时间内,物质的浓度是不变的,所以反应处于平衡状态。由于反应是放热反应,所以升高温度,平衡向逆反应方向移动,因此CO的浓度大于0.08 mol/L。②增大反应物浓度或降低温度,平衡向正反应方向移动,而催化剂不能改变平衡状态。所以应该是增大了氢气浓度,平衡向逆反应方向移动,答案选d。根据表中数据可知,5~6 min是CO的浓度减小,而水蒸气和氢气的浓度增大,说明改变的条件是增大了水蒸气的浓度,平衡向正反应方向移动,答案选a。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】已知某温度下,Ka(HCN)=6.2×10-10mol·L-1、Ka(HF)=6.8×10-4mol·L-1、Ka(CH3COOH)=1.8×10-5mol·L-1、Ka(HNO2)=6.4×10-6mol·L-1。物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A. HCN溶液 B. HF溶液 C. CH3COOH溶液 D. HNO2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
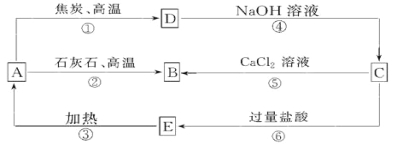
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,他们能发生如图所示的转化关系。若该元素用R表示,则A为R的氧化物,D与NaOH溶液反应生成C和H2。
请回答:
(1)写出对应物质的化学式:A__________; C__________; E__________。
(2)反应①的化学方程式为: 。
(3)反应④的离子方程式为: 。
(4)H2CO3的酸性强于E的,请用离子方程式予以证明: _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的H2SO4溶液450mL.
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D )→( A )→( )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会 ;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会 ;
③定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度。所配溶液浓度会 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,两个恒容密闭容器中分别发生反应:
①H2(g)+I2(g)![]() 2HI(g);
2HI(g);
②C(s)+H2O(g)![]() CO(g)+H2(g),
CO(g)+H2(g),
下列状态能表明两反应都达到平衡状态的是
a.各物质的浓度不变;b.容器内气体压强不变;c.容器内气体密度不变;d.容器内气体颜色不变;e.各组分的物质的量分数或质量分数不变;f.混合气体的平均分子量不变;
A. ae B. aef C. abc D. ac
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是( )
A.改变条件,反应物的转化率增大,平衡常数也一定增大
B.反应2NO2(g)===N2O4(g) ΔH<0,升高温度该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D.平衡常数为K=![]() 的反应,化学方程式为CO2+H2
的反应,化学方程式为CO2+H2![]() CO+H2O
CO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是( )。
A. CO32—、Cl— B. NO3—、Cl—
C. NO3—、SO42— D. OH—、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数K、电离平衡常数Ka、水的离子积常数Kw的说法中错误的是
A. 各常数的大小与温度有关 B. 各常数的大小说明平衡体系正反应的程度大小
C. 若温度升高则各常数一定增大 D. 各常数越大反应物平衡转化率越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com