
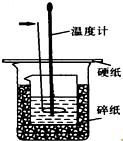
 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:分析 (1)箭头所指仪器的名称是环形玻璃搅拌棒,作用是在酸碱混合时起到搅拌的作用,让充分反应;
(2)让碱稍过量是为了让盐酸完全反应;
(3)醋酸是弱酸,电离过程会吸热,最终放出的热量会偏小,反应热是负值,△H会偏大;
(4)由图可知:大烧杯与小烧杯未相平,散热量大,误差较大;
(5)根据公式△H=-$\frac{Q}{n}$kJ/mol,再根据Q=m•c•△T计算.
解答 解:(1)箭头所指仪器的名称是环形玻璃搅拌棒,作用是在酸碱混合时起到搅拌的作用,让充分反应,
故答案为:环形玻璃搅拌棒;搅拌使充分反应;
(2)让碱稍过量是为了让盐酸完全反应,减小误差,
故答案为:保证酸完全反应;
(3)醋酸是弱酸,电离过程会吸热,最终放出的热量会偏小,反应热是负值,△H会偏大,
故答案为:偏小;偏大;
(4)由图可知:大烧杯与小烧杯未相平,散热量大,误差较大,
故答案为:大烧杯与小烧杯未相平,散热量大;
(5)根据公式△H=-$\frac{Q}{n}$kJ/mol═-57.3kJ•mol-1,50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液反应氢氧化钠过量,生成的水的物质的量为:50×10-3L×0.50mol•L-1=0.025mol,
所以Q=-△H×n(H2O)=57.3kJ•mol-1×0.025mol=1.4325kJ,因为Q=m•c•△t,所以△t=$\frac{Q}{m×c}$,溶液混合后的密度近似为1g/mL,所以混合后的总质量为100g,
代入数据△t=$\frac{1.4325kJ}{100g×4.18×1{0}^{-3}kJ•{g}^{-1}•{℃}^{-1}}$=3.4℃,
故答案为:3.4℃.
点评 本题考查学生有关中和热的测定知识,题目难度不大,注意掌握中和热的计算方法,明确中和热与酸、碱的物质的量无关.


科目:高中化学 来源: 题型:选择题
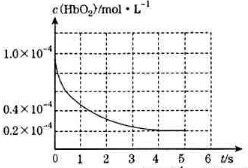 人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )
人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 反应开始至4s内用HbO2表示的平均反应速率为2×10-4mol/(L•s) | |
| B. | 反应达平衡之前,O2与HbO2的反应速率逐渐减小 | |
| C. | 将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理 | |
| D. | 该温度下反应CO+HbO2?O2+HbCO的平衡常数为107 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
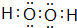 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
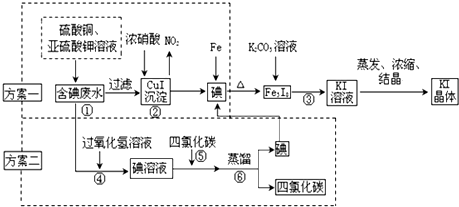
| 步骤 | 操作 | 现象 |
| 一 | 取黑色物质于烧杯中,加适量水进行洗涤、干燥 | 黑色物质未溶解 |
| 二 | 取适量固体于稀硫酸中进行充分溶解 | 无气体生成 |
| 三 | 移取少量步骤二溶液于试管A中,并滴加硫氰化钾溶液 | 溶液为血红色 |
| 四 | 移取少量步骤二溶液于试管B中,滴加酸性KMnO4溶液 | 酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用盖斯定律可计算某些难以直接测量的反应焓变 | |
| B. | 如果一个热化学方程式可通过其他几个热化学方程式相加减而得到,则该反应的焓变可由相对应的热化学方程式的焓变相加减而得到 | |
| C. | 当同一个化学反应以不同的途径完成时,反应的焓变也是不同的 | |
| D. | 对于放热反应,放出的热量越多,焓变越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
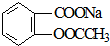 转变为
转变为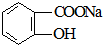 的方法为( )
的方法为( )| A. | 与足量NaOH溶液共热后,再通入CO2 | |
| B. | 与足量NaOH溶液共热后,再加入稀硫酸 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
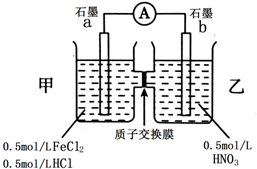
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com