
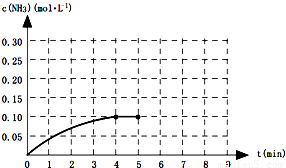
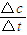 计算v(NH3);
计算v(NH3);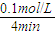 =0.025mol/(L?min),
=0.025mol/(L?min),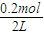 ×2=0.2mol/L,若升高温度,平衡向逆反应移动,氨完全分解,为极小值0,氨气浓度介于0到0.2mol/L之间,故不可能为0.2mol/L,由于改变温度平衡一定移动,不可能为0.1mol/L,
×2=0.2mol/L,若升高温度,平衡向逆反应移动,氨完全分解,为极小值0,氨气浓度介于0到0.2mol/L之间,故不可能为0.2mol/L,由于改变温度平衡一定移动,不可能为0.1mol/L,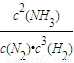 .体积缩小,压强增大,平衡向气体体积减小的方向移动,即向正反应移动.平衡常数只受温度影响,温度不变,平衡常数不变,与压强、浓度无关,
.体积缩小,压强增大,平衡向气体体积减小的方向移动,即向正反应移动.平衡常数只受温度影响,温度不变,平衡常数不变,与压强、浓度无关,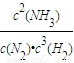 ,正向,不变;
,正向,不变;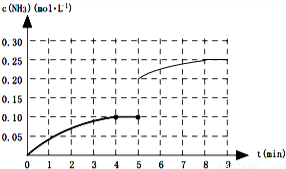 ,
, ;
;

科目:高中化学 来源: 题型:
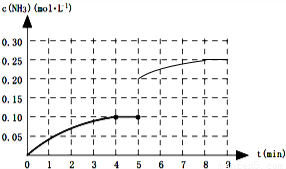
 一定温度下,向一2L的恒容密闭容器内加入0.2molN2和0.6mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图所示:
一定温度下,向一2L的恒容密闭容器内加入0.2molN2和0.6mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图所示:| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)在一定温度下,向一2L固定容积的密闭容器中通入20 molN2和60 molH2,经过5分钟后,N2的浓度是5mol∕L,又过了5分钟 N2 、H2、NH3的浓度不再变化,此时NH3的浓度是14 mol∕L,达到平衡后共放出QKJ的热量,试完成下列问题:
⑴前5分钟用H2表示的化学反应速率( );
⑵反应达到平衡后N2的转化率( );
⑶表示该温度下合成氨的化学平衡常数的表达式为( );
⑷若平衡后再增大压强,化学平衡向( )方向移动(填“正”“逆”“不”);
⑸该温度下反应的热化学方和式为( )(用含Q的式子表示);
⑹在该温度下,向另一2L固定容积的密闭容器中通入N2 5 mol、H215 mol、NH330 mol,反应达到平衡后H2的浓度是( )。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年宁夏中卫市海原一中高二第二学段考试化学试卷 题型:填空题
(12分)在一定温度下,向一2L固定容积的密闭容器中通入20 molN2和60 molH2,经过5分钟后,N2的浓度是5mol∕L,又过了5分钟 N2、H2、NH3的浓度不再变化,此时NH3的浓度是14 mol∕L,达到平衡后共放出QKJ的热量,试完成下列问题:
⑴前5分钟用H2表示的化学反应速率( );
⑵反应达到平衡后N2的转化率( );
⑶表示该温度下合成氨的化学平衡常数的表达式为( );
⑷若平衡后再增大压强,化学平衡向( )方向移动(填“正”“逆”“不”);
⑸该温度下反应的热化学方和式为( )(用含Q的式子表示);
⑹在该温度下,向另一2L固定容积的密闭容器中通入N2 5 mol、H215 mol、NH330 mol,反应达到平衡后H2的浓度是( )。
查看答案和解析>>
科目:高中化学 来源:2013届宁夏中卫市海原一中高二第二学段考试化学试卷 题型:填空题
(12分)在一定温度下,向一2L固定容积的密闭容器中通入20 molN2和60 molH2,经过5分钟后,N2的浓度是5mol∕L,又过了5分钟 N2 、H2、NH3的浓度不再变化,此时NH3的浓度是14 mol∕L,达到平衡后共放出QKJ的热量,试完成下列问题:
⑴前5分钟用H2表示的化学反应速率( );
⑵反应达到平衡后N2的转化率( );
⑶表示该温度下合成氨的化学平衡常数的表达式为( );
⑷若平衡后再增大压强,化学平衡向( )方向移动(填“正”“逆”“不”);
⑸该温度下反应的热化学方和式为( )(用含Q的式子表示);
⑹在该温度下,向另一2L固定容积的密闭容器中通入N2 5 mol、H215 mol、NH330 mol,反应达到平衡后H2的浓度是( )。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com