
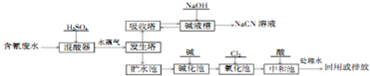
 ;
;分析 (1)电解池的阴极上发生得电子的还原反应;根据Ag+和CN-可以结合成稳定的络合物来回答;
(2)氰废水加入稀硫酸在混酸器中反应得到氰酸,通过水蒸气在发生塔中促使HCN挥发进入吸收塔,被氢氧化钠溶液吸收得到NaCN溶液,发生塔中剩余废水先经碱化后再进行氧化,CN-被氯气氧化成低毒的CNO-,CNO-被氯气氧化成无毒的两种气体氮气和二氧化碳,然后加入酸进行中和过滤的碱溶于,处理水回用或排放,
①NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键;
②氰化钠易发生水解产生氰化氢;
③CN-被氯气氧化成低毒的CNO-,同时得到还原产物氯离子;CNO-被氯气氧化成无毒的两种气体是氮气和二氧化碳,据此书写方程式;
④氢氰酸属于酸,可以和碱之间发生反应.
解答 解:(1)电解池中,电解液使用Na[Ag(CN)2],在阴极上发生得电子的还原反应,即:[Ag(CN)2]-+e-=Ag+2CN-,工业电镀中使用氰离子,这样Ag+和CN-可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密,
故答案为:[Ag(CN)2]-+e-=Ag+2CN-;Ag+和CN-可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密;
(2)①CN-中各原子均满足8电子稳定结构,存在C≡N键,电子式为 ,
,
故答案为: ;
;
②氰化钠易发生水解产生氰化氢,方程式为CN-+H2O?HCN+OH-,故答案为:CN-+H2O?HCN+OH-;
③CN-被氯气氧化成低毒的CNO-,同时得到还原产物氯离子,即CN-+Cl2+2OH-=CNO-+2Cl-+H2O;CNO-被氯气氧化成无毒的两种气体是氮气和二氧化碳,即2CNO-+3Cl2+4OH-=N2↑+CO2↑+6Cl-+2H2O;
故答案为:2CNO-+3Cl2+4OH-=N2↑+CO2↑+6Cl-+2H2O;
④贮水池中废水须先经碱化后再进行氧化,这样可以防止生成HCN,故答案为:防止生成HCN.
点评 本题是一道注重了化学与实际生产的联系的综合知识题,考查利用氧化还原反应来实现废水的转化,涉及氧化还原反应等,明确该反应中的生成物是解本题关键,还可以结合原子守恒、转移电子守恒来分析解答,题目难度中等.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.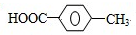 ,②化合物S可在一定条件下发生反应生成高聚物,写出该聚合反应方程式:
,②化合物S可在一定条件下发生反应生成高聚物,写出该聚合反应方程式: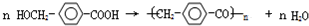 .
. 和
和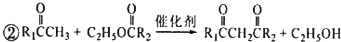 ,M的结构简式为
,M的结构简式为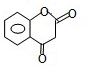 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol丙烯中含有共价键的数目为0.6NA | |
| B. | 0.1mo Cl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 标准状况下,2.24LSO3中含有氧原子的数目为0.3NA | |
| D. | 9.2g由乙醇和二甲醚(CH3OCH3)组成的混合物中含有氧原子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
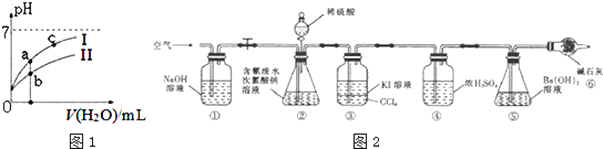
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol/LCH3COONa溶液与0.1 mol/LCaCl2溶液等体积混合:c(Na+)+c(Ca2+)═c(CH3COO-)+c(CH3COOH)+2c(Cl- ) | |
| B. | 将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)═c(OH-)+c(CO32-)+c(NH3•H2O) | |
| C. | 0.1 mol/LCH3COONa溶液与0.1 mol/LHCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) | |
| D. | 0.2mol/L氨水与0.1 mol/LHCl溶液等体积混合:c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com