
����Ŀ���ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����
��1��Ŀǰ��ҵ����һ�ַ�������CO2��H2��230������������ת�����ɼ״���CH3OH��������ˮ����CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g������ͼ��ʾ��ѹ�����г���1mol CO2��3 mol H2��ת���ʴ�50%ʱ�������仯ʾ��ͼ��д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
CH3OH��g��+H2O��g������ͼ��ʾ��ѹ�����г���1mol CO2��3 mol H2��ת���ʴ�50%ʱ�������仯ʾ��ͼ��д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��

��2�����ҵ�ϻ�����CO��H2�Ʊ��״��� ��ӦΪCO��g��+2H2��g��![]() CH3OH��g����
CH3OH��g����
ij�¶��£����ݻ�Ϊ2L�ĺ����ܱ������н��и÷�Ӧ����������ݼ���ͼ��

�� t min��2t minʱ���ʱ仯��ԭ������� ��
�� 3t minʱ�Է�Ӧ��ϵ��ȡ��һ����ʩ����4t minʱCO�����ʵ���Ϊ0.5mol���������ͼCO�����ߡ�
��3��CO2��һ�������£���������H2�ϳɶ����ѣ�
2CO2��g��+6H2��g��![]() CH3OCH3��g��+3H2O��g����
CH3OCH3��g��+3H2O��g����
��2.5 mol H2��b mol CO2�����ݻ�Ϊ1 L���ܱ������У�����������Ӧ���ﵽƽ��״̬ʱ�����ʵ���������±���

�� ����ʱ������ƽ����_________�����ƶ��������Ӧ�����淴Ӧ������
�ڱ���x��y�Ĵ�С��ϵΪ_________��
A��x��y B��x��y C��x��y D�����ж�
�۱���x��y��z��w��Ӧ��ƽ�ⳣ���ֱ�ΪKx��Ky��Kz��Kw������֮��Ĵ�С��ϵΪ___________________��
���𰸡���1����1��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�� ��H =��39.2 kJ��mol-1
CH3OH��g��+H2O��g�� ��H =��39.2 kJ��mol-1
��2�������»�ʹ���˴�������ѹ���÷֣���Ϊ����Ѹ��������ݡ���
��
��3��������Ӧ
��B
��Kx��Kz��Ky��Kw
��������
���������
��1��������ͼ��֪1mol CO2��3mol H2ת���ʴ�50%ʱ����23-3.4=19.6KJ����÷�Ӧ���Ȼ�ѧ����ʽ��CO2��g��+3H2��g��CH3OH��g��+H2O��g������H=-![]() =-39.2kJmol-1���ʴ�Ϊ��CO2��g��+3H2��g�� CH3OH��g��+H2O��g������H=-39.2 kJmol-1��
=-39.2kJmol-1���ʴ�Ϊ��CO2��g��+3H2��g�� CH3OH��g��+H2O��g������H=-39.2 kJmol-1��
��2����t minʱ�̸���ֵ����ʵ���δ��������Ӧ���ʼӿ�����������Ѹ��������ݻ�Ϊ2L������������ʹ���˴����������¶����ʴ�Ϊ��ʹ���˴����������¶�����3tminʱ�ı������״������ʵ��������������ʵ�����С��˵���ı�����ʹƽ��������Ӧ�����ƶ���3tminʱCO�����ʵ���Ϊ0.4mol�����ı�����ʹƽ�������ƶ���4tmin�ﵽ��ƽ��ʱCO�����ʵ���Ϊ0.5mol��ƽ�����ƶ���Ӧ��CO�����ʵ�������������˵��3tminʱ���ı�������Ǽ�����CO��3tmin��4tminʱ�������ʵ�����С0.2mol����Ӧ���ĵ�COΪ0.1mol����4tminʱCO�����ʵ���Ϊ0.5mol����3tminʱCO���ʵ���Ϊ0.6mol������3tminʱ��ȡ�Ĵ�ʩ�Ǽ���0.2molCO����CO�ı仯����Ϊ��

��3����CO2��ʼ���ʵ���Ϊ1.25molʱ���¶ȵͣ�CO2��ת����Խ��˵�������¶�ƽ��������Ӧ�����ƶ����ʴ�Ϊ������Ӧ����CO2��ʼ���ʵ���Ϊ1.25molʱ���¶�Խ�ߣ�CO2��ת����ԽС��˵������Ӧ�Ƿ��ȷ�Ӧ����w��32��x��33������CO2��g����H2��g�������ʵ���1��3��Ӧ��H2��g�����ʵ���Ϊ2.5mol������CO2�����ʵ�����b��Խ��CO2��ת����ԽС����y��w���ۺ�����������֪x��33��32��w��y���ʴ�ΪB����ƽ�ⳣ��ֻ���¶ȵĺ������¶Ȳ��䣬ƽ�ⳣ��Kֵ���䣬ͨ������������֪�÷�ӦΪ���ȷ�Ӧ�����������¶�ƽ�������ƶ���ƽ�ⳣ��Kֵ��С��������Kx��Kz��Ky��Kw���ʴ�ΪKx��Kz��Ky��Kw��


 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ѧ�м��ֳ������ʵ�ת����ϵ��ͼ��ʾ(ͼ�в��ַ�Ӧ��������P��Ӧ����δ�г�)��
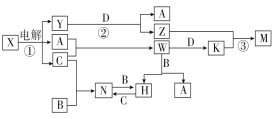
��֪��A��B��C��D�ǵ��ʣ������ǻ��������B��D�dz��������������B��Ԫ�����ڹ���Ԫ�ء���֪A��C�е�ȼ�в�ɫ���棬M�ȿ����������ֿ�����NaOH��Һ����ش��������⣺
��1��W�ĵ���ʽ�� ��
��2��д��N�Ļ�ѧʽ ������дһ��N����Ҫ��; ��
��3��д�����з�Ӧ�����ӷ���ʽ��
��Ӧ�� ��
��Ӧ�� ��
K��Һ������ˮ��Ӧ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC7H16�������У�����3������ͬ���칹�����ĿΪ�� ��
A��2�� B��3�� C��4�� D��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڲ�ͬ�ܼ�����NaOH������ͬ���͵ķ�Ӧ�����ɲ�ͬ�ķ�Ӧ���ijͬѧ��������������ʣ�����ͼʵ��װ��(����̨���ƾ�����)��֤ȡ����Ӧ����ȥ��Ӧ�IJ������һ�����̽����
ʵ������������Թ��м���5 mL 1 mol/L NaOH��Һ��5 mL�����飬��
ʵ�����II�����Թ���ͼ�̶���ˮԡ���ȡ�

��1����ˮԡ���ȶ���ֱ���þƾ��Ƽ��ȵ�ԭ����________��
��2���۲쵽___________����ʱ��������������NaOH��Һ����ȫ��Ӧ��
��3���������������Ҵ��Ľṹ�����õIJ�����_____��
��4��Ϊ֤����������NaOH�Ҵ���Һ�з���������ȥ��Ӧ��������Ƶ�ʵ�鷽���У���Ҫ�������____������ķ����� (��˵�������õ��Լ�����ʵ�������Ԥ�������ʵ������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƿ�չ�е�����Դ���������ð�������Ʊ��������Ӧ���������ڡ��ش��������⣺
��1����������ȣ�������Ϊȼ�ϵ��ŵ���_________(���ٴ������)����������ֱ��ȼ�յ�����ת����Զ����ȼ�ϵ�أ�д����������ȼ�ϵ�صĸ�����Ӧʽ��____________��
��5�����������ĸ�����Ҳ����������Դ����ⷨ��ȡ�й㷺��;��Na2FeO4��ͬʱ���������Fe+2H2O+2OH![]() FeO42+3H2��������ԭ����ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��
FeO42+3H2��������ԭ����ͼ1��ʾ��װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ�����������������ҺŨ�ȹ��ߣ����缫����������ɫ���ʡ���֪��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ��
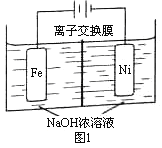

�����һ��ʱ���c(OH)���͵�������_______(������������������������)��
���������У��뽫�������������弰ʱ�ų�����ԭ����_______��
��c( Na2FeO4)���ʼc(NaOH)�ı仯��ͼ2����ѡM��N�����е�һ�㣬����c(Na2FeO4)�������ֵ��ԭ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�������������治��ȱ�ٵ����ʣ�ˮ������ֱ��Ӱ�����彡����Ϊ��̽��ˮ�����ӣ�ij�ۺ�ʵ��С��������ˮ���ιۣ��˽Դˮ����������ˮ�Ĺ�������ʾ��ͼ��ͼ��ʾ��


�ṩ���Լ�������K2CO3��Һ��NaOH��Һ��Ba��NO3��2��Һ��75%���Ҵ�����ʯ�ҡ�CCl4��BaCl2��Һ
��1����Ȼˮ���ܽ��������Ҫ�� �� ��Ӳ��Ϊ1����ˮ��ָÿ��ˮ��10mg CaO����֮�൱�����ʣ���7.1mg MgO����ij��Ȼˮ��c��Ca2+��=1.2��10��3molL��1��c��Mg2+��=6��10��4molL��1�����ˮ��Ӳ��Ϊ ��
��2��Ϊ��ȥԴˮ�к���Ca2+��Mg2+��HCO3����Cl����SO42�������ӣ�ѡ��a���������Լ����������˳������Ϊ ��ֻ�ѧʽ����
��3����Ȼˮ�ھ������������м���Ļ����������� ���侻ˮ���õ�ԭ���� ��
��4����ɡ�ұ���͵�ƹ�ҵ������������軯�������ˮ�����к��軯������HCN��CN���ͽ���������M��CN��mn����ʽ������ˮ�У��ⶨ��ˮ�к��軯���ﺬ����ʵ�鲽�����£�
����ˮ��Ԥ������ˮ���м��������EDTA����pH��2�������¼��������������е�HCN������NaOH��Һ������
�����ζ���������Һ������pH��ll����������������ָʾ������AgNO3����Һ�ζ����յ�ʱ��Һ�ɻ�ɫ��ɳȺ�ɫ����Ӧ�����ӷ���ʽΪ��Ag++2CN���T[Ag��CN��2]����
��������֪ʶ�ش�����������
��ˮ��Ԥ������Ŀ���� ��
��ˮ��Ԥ������װ����ͼ��ʾ��ϸ���ܲ�������Һ�е�Ŀ���� ������ƿ������Һ��Ҫ�ߣ���ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ӦA2(g)+B2(g)![]() 2AB(g)�ﵽƽ��ı�־�� ( )
2AB(g)�ﵽƽ��ı�־�� ( )
A.��������и����ʵ�Ũ����ȡ�
B.��λʱ��������2nmolABͬʱ����nmolB2 ��
C.��λʱ��������nmolA2ͬʱ����nmolB2 ��
D.��λʱ��������nmolA2ͬʱ����nmolAB ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ijʵ��С���H2O2�ķֽ���������̽�����±��Ǹ�ʵ��С���о�Ӱ��H2O2�ֽ����ʵ�����ʱ��¼��һ�����ݣ���������ͬ��״̬��ͬ��MnO2�ֱ����ʢ��15 ml 5%��H2O2��Һ�Ĵ��Թ��У����ô����ǵ�ľ�����ԣ�������£�

��1��д������ʵ���з�����Ӧ�Ļ�ѧ����ʽ ��
��2��ʵ���������������Ĵ�Ч���� �йء�
��. ���о�֪Cu2+��H2O2�ֽ�Ҳ���д����ã�Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����ij�о�С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�顣�ش�������⣺
��3�����Է�������ͼ��ͨ���۲� �����ԱȽϵó����ۡ���ͬѧ�����FeCl3��ΪFe2(SO4)3��Ϊ�������������� ��

��4��������������ͼ����ʾ��ʵ��ʱ��������40 mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԡ�ͼ������A������Ϊ ��ʵ������Ҫ������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ����ʻ�Ӧ�õ�˵����ȷ����
A��������ǹ�����Ʒ����Ҫ��ѧ�ɷ� B���Ͻ����ٺ��������ϵĽ���Ԫ��
C������ɲ��������ЧӦ D��ʯ�ͷ���ɻ����ϩ������ͱ�ϩ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com