
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
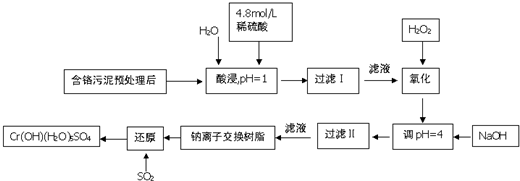
分析 含铬污泥酸浸后滤去不溶物,滤液中加入过氧化氢,由(2)可知过氧化氢将Cr3+氧化为Cr2O72-,此外将Fe2+氧化为Fe3+,再加入NaOH调节pH=4,使Fe3+转化为Fe(OH)3,过滤除去,滤液经过钠离子交换树脂后,被二氧化硫还原得到CrOH(H2O)5SO4,则钠离子交换膜除去溶液中Al3+、Ca2+、Mg2+.
(1)酸浸是溶解物质为了提高浸取率,可以增大接触面积,延长浸取时间,升高温度,过滤后再向滤渣中加入硫酸(多次浸取)等;
(2)另外作用是将Fe2+氧化为Fe3+;
(3)过滤Ⅱ得到沉淀为氢氧化铁;
(4)钠离子交换膜除去溶液中Al3+、Ca2+、Mg2+;
(5)反应中Cr元素化合价由+6价降低为+3价,S元素由+4价升高为+6价,根据电子转移守恒计算消耗SO2物的质量;
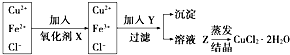
(6)①Fe为阳极,发生反应:Fe-2e-=Fe2+,得到还原性的Fe2+离子将还原Cr2O72-还原为Cr3+,阴极发生反应:2H++2e-=H2↑,溶液中氢离子浓度减小,溶液pH增大,Cr3+、Fe3+转化为Cr(OH)3和Fe(OH)3沉淀除去;
②根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)、Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)计算.
解答 解:含铬污泥酸浸后滤去不溶物,滤液中加入过氧化氢,由(2)可知过氧化氢将Cr3+氧化为Cr2O72-,此外将Fe2+氧化为Fe3+,再加入NaOH调节pH=4,使Fe3+转化为Fe(OH)3,过滤除去,滤液经过钠离子交换树脂后,被二氧化硫还原得到CrOH(H2O)5SO4,则钠离子交换膜除去溶液中Al3+、Ca2+、Mg2+.
(1)酸浸是溶解物质为了提高浸取率,可以将污泥粉碎、进行搅拌,以增大接触面积,可以延长浸取时间,可以升高温度,也可以过滤后再向滤渣中加入硫酸,进行多次浸取,合并浸取液,
故选:ABC;
(2)另外作用是将Fe2+氧化为Fe3+,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)由上述分析可知,过滤Ⅱ产生的沉淀为Fe(OH)3,
故答案为:Fe(OH)3;
(4)钠离子交换膜除去溶液中Al3+、Ca2+、Mg2+,故被交换的离子为:,
故答案为:Al3+、Ca2+、Mg2+;
(5)反应中Cr元素化合价由+6价降低为+3价,S元素由+4价升高为+6价,根据电子转移守恒,消耗SO2物的质量为$\frac{1mol×(6-3)}{6-4}$=1.5mol,
故答案为:1.5mol;
(6)①Fe为阳极,发生反应:Fe-2e-=Fe2+,得到还原性的Fe2+离子将还原Cr2O72-还原为Cr3+,阴极发生反应:2H++2e-=H2↑,溶液中氢离子浓度减小,溶液pH增大,Cr3+、Fe3+转化为Cr(OH)3和Fe(OH)3沉淀除去,铁电极与直流电源正极相连,加入适量NaCl的目的是增大溶液导电能力,
故答案为:正极;增大溶液导电能力;
②Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.0×10-13×c3(OH-)=4.0×10-38,
而Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.0×10-31,
联立可得c(Cr3+)=3.0×10-6mol/L,
故答案为:3.0×10-6mol/L.
点评 本题以化学工艺流程为载体,考查物质分离提纯、对原理与操作的分析评价、信息获取与迁移运用、氧化还原反应计算、电解原理、溶度积有关计算等,题目综合性强,侧重考查学生分析解决问题的能力,是高考题的常见形式,关键是理解工艺流程,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3含有的分子数NA | |
| B. | 常温常压下,4.4gCO2的物质的量一定为0.1mol | |
| C. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L | |
| D. | 7.8gNa2S和7.8gNa2O2中含有的阴离子数目均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内质子数为15的元素的最高正价为+3 | |
| B. | 电子层数相同时,最外层7个电子的元素非金属性最强 | |
| C. | 原子序数从11依次增加到17,原子半径逐渐增大 | |
| D. | 随着原子序数的增加,元素原子最外层电子数逐渐增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4+(2)
NH4+(2) H2O(3)
H2O(3) NH3
NH3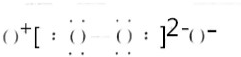 Na2O2(5)
Na2O2(5)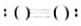 N2
N2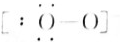 OH-(7)
OH-(7)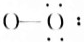 HF.
HF.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
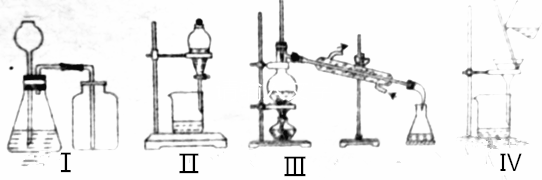
| A. | 选择装置Ⅰ用铜与浓硝酸反应制备NO2 | |
| B. | 选择装置Ⅱ分离乙酸乙酯和饱和碳酸氢钠溶液的混合物 | |
| C. | 选择装置Ⅲ分离对硝酸甲苯和邻硝基甲苯 | |
| D. | 选择装置Ⅳ分离饱和硫代硫酸钠溶液和硫代硫酸钠晶体的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,12gC60和C70的混合物中含有的碳原子数为NA | |
| B. | 22.4L SO2气体中含有的氧原子数为2NA | |
| C. | 1.0L 1.0mol•L-1CH3COOH溶液中含有的CH3COOH分子数为NA | |
| D. | 标准状况下,5.6LCCl4含有的分子数为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为负极、Y为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 在标况下通过5.6 L O2完全反应则有l.0 mol 电子发生转移 | |
| D. | 该电池工作时甲烷一极附近溶液 pH降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com