
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
| ||
| 4 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
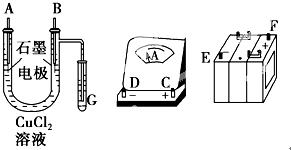 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )
如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )| A、该反应的化学方程式可表达为2M+N?2P |
| B、在反应时间为20min-25min之内,物质M的反应速率为0.002mol/(L?min) |
| C、当反应时间为20min时,曲线开始发生变化的原理可能是由于增大压强引起的 |
| D、反应在10min达到化学平衡状态,若曲线的变化是由于升温造成的(其它条件不变),则该反应的正反应一定为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |

查看答案和解析>>
科目:高中化学 来源: 题型:
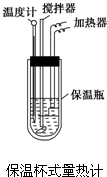 在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应一定是氧化还原反应 |
| B、分解反应一定不是氧化还原反应 |
| C、置换反应一定是氧化还原反应 |
| D、复分解反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙呈红色的溶液:NH4+、Na+、Al02-、HC03- | ||
| B、c(NH3?H2O)=1.Omol?L-1的溶液:K+、Al3+、S042-、Cl- | ||
| C、由水电离的c(H+)=10-12mol?L-1的溶液:K+、Ba2+、Cl-、Br- | ||
D、在
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com