
| A. | 煤的干馏属于物理变化 | |
| B. | 油脂在酸性或碱性条件下的水解反应叫做皂化反应 | |
| C. | 石油分馏得到的各馏分都是纯净物 | |
| D. | 淀粉和纤维素在一定条件下水解均可得到葡萄糖 |
分析 A.物理变化无新物质生成,煤的干馏有新物质生成;
B.油脂在碱性条件下水解出硬质酸钠和甘油为皂化反应;
C.石油的各种馏分仍然是混合物;
D.淀粉和纤维素均为多糖,为葡萄糖的脱水缩合物.
解答 解:A.煤的干馏指煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程,有新物质生成,属于化学变化,故A错误;
B.肥皂的主要成分是硬质酸钠,而油脂只有在碱性条件下水解才能水解出硬质酸钠,在酸性条件下水解出硬脂酸,故油脂在碱性条件下的水解才称为皂化反应,故B错误;
C.石油的各种馏分仍然是多种烷烃和环烷烃的混合物,无固定熔沸点,故C错误;
D.淀粉和纤维素均为葡萄糖的脱水缩合物,故淀粉和纤维素水解后均得葡萄糖,故D正确;
故选D.
点评 本题考查了化学在生产和生活中的应用,题目难度不大,应注意的是煤的干馏是化学变化,而石油的分馏是物理变化.


科目:高中化学 来源: 题型:选择题
| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCH4和CH2C12的混合物所含分子数为NA | |
| B. | 用含0.2mo1 FeC13的饱和溶液制得胶体,其中所含氢氧化铁胶粒的数目为0.2 NA | |
| C. | 由NO2和CO2组成的混合气体中共有NA个分子,其中氧元素的质量一定为32g | |
| D. | 2LpH=1的HA酸溶液与足量锌粒反应,生成H2的分子数一定为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | D | |
| E |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na原子最外层有1个电子 | B. | Na单质能跟水反应放出氢气 | ||
| C. | Na原子比Mg原子更易失去电子 | D. | Na与氧气在加热条件下生成氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2→CH3CH2Cl | B. | CH≡CH→CH3-CH3 | ||
| C. | CH3CH2OH→CH2=CH2 | D. | 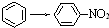 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaC2与水反应制乙炔,乙烯与水反应制乙醇--水解反应 | |
| B. | 由苯制硝基苯,由甲苯制TNT--消化反应 | |
| C. | 油脂的硬化,油脂的氢化--加聚反应 | |
| D. | 乙醇与酸性K2Cr2O7溶液反应,乙醛与新制Cu(OH)2浊液反应--氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com