
| A. | 浓度均为0.1mol/L的HCN溶液和NaCN溶液等体积混合后溶液呈碱性c(CN-)>c(Na+)>c(HCN)>c(OH-)>c(H+) | |
| B. | pH=a的醋酸溶液,稀释100倍后,其pH=b,则a+2<b | |
| C. | c(NH4+)相同的①氯化铵②硫酸氢铵③次氯酸铵④碳酸铵四种溶液中pH:④>②>①>③ | |
| D. | pH=5的H2S溶液中:c(HS-)<c(H+)=1×10-5mol/L |
分析 A.等浓度的HCN溶液和NaCN溶液等体积混合后溶液呈碱性,说明CN-的水解程度大于HCN电离程度,则c(HCN)>c(Na+)>c(CN-);
B.醋酸为弱酸,稀释100倍后,其pH变化小于2个单位;
C.硫酸氢铵完全电离出氢离子,溶液酸性最强,其pH最小;氯化铵溶液中铵根离子部分水解,溶液显示弱酸性;③次氯酸铵和④碳酸铵溶液中,次氯酸根离子、碳酸根离子的水解程度大于铵根离子,溶液显示碱性,且碳酸根离子的水解程度大于次氯酸根离子,则④的碱性更强,溶液的pH更大;
D.硫化氢为二元弱酸,在溶液中部分电离出硫氢根离子,且溶液中氢离子来自硫化氢和水的电离,则c(HS-)<c(H+)=1×10-4mol/L.
解答 解:A.浓度均为0.1mol/L的HCN溶液和NaCN溶液等体积混合后溶液呈碱性,说明CN-的水解程度大于HCN电离程度,则:c(HCN)>c(Na+)>c(CN-)、(OH-)>c(H+),溶液中离子浓度大小为:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+),故A错误;
B.pH=a的醋酸溶液,稀释100倍后醋酸的电离程度增大,则稀释后溶液的pH变化小于2个单位,则a+2>b,故B错误;
C.c(NH4+)相同的①氯化铵②硫酸氢铵③次氯酸铵④碳酸铵四种溶液中,②硫酸氢铵完全电离出氢离子,溶液酸性最强,溶液的pH最小;③次氯酸铵和④碳酸铵溶液中,次氯酸根离子、碳酸根离子的水解程度大于铵根离子,溶液显示碱性,且碳酸根离子的水解程度大于次氯酸根离子,则④的碱性更强,溶液的pH更大,所以溶液pH大小为:④>③>①>②,故C错误;
D.pH=5的H2S溶液中,c(H+)=1×10-5mol/L,由于氢离子来自水的电离和硫化氢的电离,而硫氢根离子来自硫化氢的电子,则溶液中离子浓度大小为:c(HS-)<c(H+)=1×10-5mol/L,故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及离子浓度大小比较、弱电解质的电离及其影响、盐的水解原理等知识,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:解答题
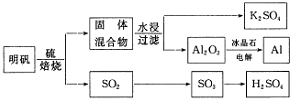
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 单质氧化性:X>Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数相同的不同原子,其化学性质一定相同 | |
| B. | 质子数相同的原子,其核外电子排布也相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子晶体中,一定不存在共价键 | B. | 原子晶体中,只存在共价键 | ||
| C. | 金属晶体的熔沸点均很高 | D. | 稀有气体的原子能形成分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
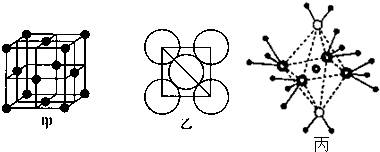
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )
甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )| A. | 分子式为C25H20 | B. | 所有的碳原子可能都在同一平面上 | ||
| C. | 所有原子一定在同一平面上 | D. | 此物质属于芳香烃类物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com