
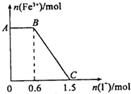
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 开始加入的K2Cr2O7为0.25mol | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | K2Cr2O7与FeSO4反应的物质的量之比为1:3 |
分析 氧化性强弱顺序为K2Cr2O7>Fe3+,由图象可知,在反应后的溶液中滴加碘化钾溶液,开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,BC段为铁离子和碘化钾的反应,结合得失电子守恒解答该题.
解答 解:A.开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,K2Cr2O7为氧化剂,故A正确;
B.由氧化剂和还原剂得失电子数目相等可知反应的关系式为K2Cr2O7~6Fe3+~6I-,共消耗的n(I-)=1.5mol,则开始加入的K2Cr2O7的物质的量为$\frac{1.5}{6}$mol=0.25mol,故B正确;
C.BC段Fe3+浓度逐渐减小,为铁离子和碘化钾的反应,反应的离子方程式为2Fe3++2I-=2Fe2++I2,故C正确;
D.由方程式2Fe3++2I-→2Fe2++I2可知,BC段消耗KI0.9mol,则n(Fe3+)=n(Fe2+)=0.9mol,K2Cr2O7可与FeSO4反应的物质的量为0.25mol:0.9mol=5:18,故D错误.
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握发生的反应及电子守恒计算该题,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 碘酒、液态氧、烧碱 | B. | 纯碱、白磷、生石灰 | ||
| C. | 氯化氢、钠、干冰 | D. | 胆矾、氮气、空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6mL | B. | 12mL | C. | 24mL | D. | 18mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧元素的质量比为5:6 | B. | 氧原子的物质的量之比为3:2 | ||
| C. | 所含硫原子的物质的量之比为1:1 | D. | 硫元素的质量比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过氧化钠和水反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 明矾净水作用:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| C. | 少量SO2气体通入NaClO溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+ | |
| D. | 过量的CO2通入NaAlO2溶液中:2AlO2-+CO2+3H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | B. | 钾原子的结构示意图: | ||
| C. | HCN的电子式: | D. | 芒硝的化学式:Na2CO3•10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=4的醋酸中:c(H+)=1.0×10-4 mol•L-1 | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,溶液pH增大 | B. | 通入CO2,平衡朝正反应方向移动 | ||
| C. | 升高温度,$\frac{{c(HC{O_3}^-)}}{{c(C{O_3}^{2-})}}$减小 | D. | 加入NaOH固体,溶液pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com