
| A. | Na+、K+、SO42-、Cl- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | H+、K+、HCO3-、Cl- | D. | Mg2+、Na+、Cl-、SO42- |
分析 A.四种离子的浓度均为1mol/L时不满足电荷守恒;
B.铜离子为有色离子,不满足溶液无色的条件;
C.氢离子与碳酸氢根离子反应;
D.四种离子之间不反应,浓度相等时满足电荷守恒.
解答 解:A.Na+、K+、SO42-、Cl-的浓度相等时,阴离子总电荷浓度大于阳离子,违反了电荷守恒,违反配制该溶液,故A错误;
B.Cu2+为有色离子,不满足溶液无色的要求,故B错误;
C.H+、HCO3-之间发生反应,在溶液中不能大量共存,故C错误;
D.Mg2+、Na+、Cl-、SO42-之间不发生反应,浓度相等时满足电荷守恒,可以配制该溶液,故D正确;
故选D.
点评 本题考查离子共存的判断及应用,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件“混合物溶液中四种离子的浓度均为1mol/L”;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度,W(g)体积分数增加,则正反应是放热反应 | |
| B. | 减小X浓度,平衡向逆反应方向移动,平衡常数K减小 | |
| C. | 平衡正向移动,化学平衡常数一定增大 | |
| D. | 该反应可表示为X(g)+2Y(g)?2Z(g)+2W(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、NO3- | B. | Fe3+、K+、Cl-、HCO3- | ||
| C. | Cu2+、Na+、Cl-、SO42- | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、Cl2都能使品红溶液褪色 | |
| B. | NH4Cl晶体、固体碘受热时都能气化 | |
| C. | 乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色 | |
| D. | 葡萄糖、乙醛分别与新制Cu(OH)2共热时都能产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
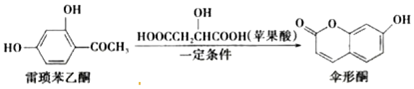
| A. | 雷琐苯乙酮有两种含氧官能团 | |
| B. | 1 mol伞形酮与足量 NaOH溶液反应,最多可消耗 2 mol NaOH | |
| C. | 伞形酮难溶于水 | |
| D. | 雷琐苯乙酮和伞形酮都能跟 FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | 大量氢离子的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2O | |
| D. | 稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
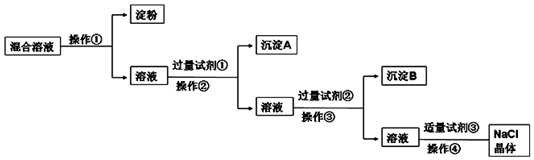
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| B. | 能自发进行的反应一定能迅速发生 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独做为判断反应能否自发进行的判据 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都可能自发 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com