
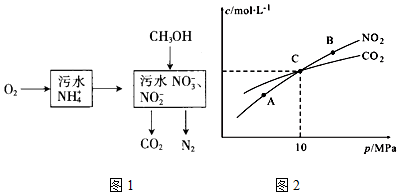
分析 (1)①NO2-的污水与含NH4+的污水按比例混合,转化的无毒气体是氮气;
②根据空气将NH4+转变为NO3-或NO2-的反应为:NH4++2O2=NO3-+2H++H2O,酸性增强;
③根据得失电子守恒计算;
(2)①根据化学平衡常数与温度有关,温度不变,k不变;
②该反应是个气体体积减小的反应,压强增大,反应逆向移动;
③C点时NO2和CO2浓度相等,三段式计算C点各物质的物质的量,再根据分压计算Kp(C).
解答 解:(1)①NO2-的污水与含NH4+的污水按比例混合,转化的无毒气体是氮气;
故答案为:N2;
②空气将NH4+转变为NO3-或NO2-的反应为:NH4++2O2=NO3-+2H++H2O,酸性增强,PH减小;
故答案为:减小;
③全处理含1mol NH4+污水,整个过程铵根离子、甲醇是还原剂,只有氧气是氧化剂,氧气得到的电子为4n(O2)mol,1molNH4+失电子为3mol,甲醇失电子为6n(CH3OH),根据得失电子守恒则:4n(O2)=3+6n(CH3OH);
故答案为:4 n(O2)=3+6n(CH3OH);
(2)①A、B两点温度相等,所以化学平衡常数相等;
故答案为:=;
②由方程式可知反应气体体积减小,增大压强,平衡逆向移动,NO2的转化率降低,A、B、CA点压强最小,所以转化率最高;
故答案为:A;
③设生成二氧化碳2x mol,列三段式:
2NO2(g)+2C(s )?N2(g)+2CO2(g)
起始物质的量:1 0 0
转化物质的量:2x x 2x
平衡物质的量:1-2x x 2x
C点时NO2和CO2浓度相等,则1-2x=2x,解得:x=0.25,因,C点时NO2和CO2浓度相等,则NO2和CO2的分压也相等,即Kp(NO2)=Kp(CO2),Kp(C)=$\frac{K{p}^{2}(C{O}_{2})•Kp({N}_{2})}{K{p}^{2}(N{O}_{2})}$=Kp(N2)=10MPa×$\frac{0.25}{0.5+0.25+0.5}$=2MPa;
故答案为:2 MPa.
点评 本题考查了氧化还原反应、化学平衡的相关原理和计算,要求学生基础扎实,综合性强,题目难度大,读懂信息是关键.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钡、四氯化碳、硫酸、碘酒都属于化合物 | |
| B. | 硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、碱、盐、氧化物 | |
| C. | 溶液、浊液、胶体、空气都属于混合物 | |
| D. | CO2、SO2、P2O5、CO都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2和3 | B. | 3和2 | C. | 3和1 | D. | 1和3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe比Cu的金属性强,因此可用FeCl3腐蚀Cu刻制应刷电路板 | |
| B. | 纯碱、小苏打、盐酸分别属于碱、盐、混合物 | |
| C. | 胶体化学是制造纳米材料的有效方法之一 | |
| D. | 用萃取方法分离碘的苯溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com