
| X | L | Z |
| Y | W |
| A. | Y的原子半径一定比L的大 | |
| B. | 若X、Y为非金属元素,则X、Y元素形成的单质晶体类型一定相同 | |
| C. | 若X、W能组成XW型分子,则其空间构型分子,则其空间构型一定为直线型 | |
| D. | 对应简单氢化物的沸点可能是X>Y、Z>W |
分析 A.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
B.若X、Y为非金属元素,可以是X为C、Y为Si,C的单质可以为原子晶体、分子晶体,硅的单质为原子晶体;
C.两原子形成的分子一定为直线型结构;
D.若X为N、Y为P,则Z为F、W为Cl,根据氢键进行分析解答.
解答 解:A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径Y>L,故A正确;
B.若X、Y为非金属元素,可以是X为C、Y为Si,C的单质中金刚石为原子晶体,C60等为分子晶体,石墨为混合晶型,而硅单质为原子晶体,故B错误;
C.两原子形成的分子一定为直线型结构,故C正确;
D.若X为N、Y为P,则Z为F、W为Cl,氨气分子之间存在氢键,沸点高于PH3的,HF分子之间存在氢键,沸点高于HCl的,故D正确,
故选B.
点评 本题考查元素周期表与元素周期律,熟练掌握元素周期律的结构是解题关键,注意元素的不确定性,难度中等.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.4mol/(L•S) | B. | v(C)=0.5mol/(L•S) | C. | v(B)=0.6mol/(L•S) | D. | v(A)=0.15mol/(L•S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
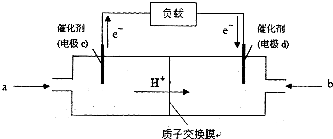
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
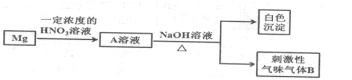
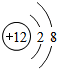 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 李比希基团理论、逆合成分析理论、范特霍夫对有机化合物结构的三维认识都为有机化学的发展作出贡献 | |
| B. | 同位素示踪法、核磁共振法、红外光谱法、质谱法等是研究有机反应机理的重要方法 | |
| C. | 洗气、蒸馏、萃取、分液、结晶等是有机化合物的分离与提纯的常见方法 | |
| D. | 德国化学家维勒在制备氰酸铵时得到了尿素,打破了无机物和有机物的界限 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
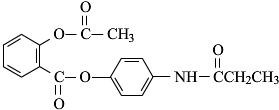 ,由它可衍生出一系列物质,有关变化如图:
,由它可衍生出一系列物质,有关变化如图: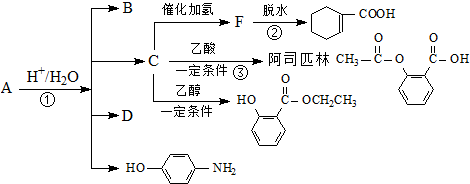
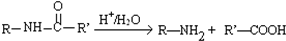
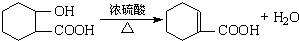 .
. .
.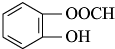 (或间位或对位).
(或间位或对位).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯碱吸收硫酸工业的尾气 | B. | 用烧碱吸收氯碱工业的尾气 | ||
| C. | 用纯碱吸收合成氨工业的尾气 | D. | 用烧碱吸收炼铁工业的尾气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com