
按要求书写方程式:
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平__________________。
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO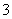 反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式_____________________________。
反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式_____________________________。
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O ,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式________________________________________________________________________
,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式________________________________________________________________________
________________________________________________________________________。
(3)KMnO4的氧化性随pH的减小而增大,在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2。三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式______________________________________________________
________________________________________________________________________。
(4)已知:①MnO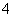 +e-―→MnO
+e-―→MnO (绿色)(强碱性条件)
(绿色)(强碱性条件)
②MnO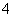 +8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)
+8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)
将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式________________________________________________________________________
________________________________________________________________________。
答案 (1)①2KMnO4+10KCl+8H2SO4===6K2SO4+2MnSO4+5Cl2↑+8H2O
②2Mn2++5NaBiO3+14H+===2MnO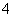 +5Na++5Bi3++7H2O
+5Na++5Bi3++7H2O
(2)Cr2O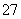 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
(3)2KMnO4+C2HCl3===2KCl+2CO2↑+2MnO2+HCl
(4)4MnO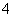 +4OH-
+4OH-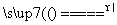 4
4 MnO
MnO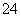 +2H2O+O2↑
+2H2O+O2↑
解析 (1)①根据信息,KMnO4在H2SO4作用下,把KCl氧化成Cl2,本身被还原成
Mn2+。②注意NaBiO3不能拆写成离子形式。NaBiO3作为氧化剂,把Mn2+氧化成MnO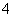 ,本身被还原成Bi3+。(3)根据信息,MnO
,本身被还原成Bi3+。(3)根据信息,MnO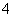 的还原产物为MnO2,C2HCl3中C被氧化为CO2,H、Cl的化合价不发生变化。(4)根据信息,在强碱性条件下,MnO
的还原产物为MnO2,C2HCl3中C被氧化为CO2,H、Cl的化合价不发生变化。(4)根据信息,在强碱性条件下,MnO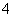 得电子生成MnO
得电子生成MnO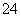 ,-2价的氧失电子生成O2。
,-2价的氧失电子生成O2。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
下列关于Na2CO3和NaHCO3性质的说法错误的是 ( )
A.热稳定性:NaHCO3<Na2CO3
B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3
C.相同温度时,在水中的溶解性:NaHCO3<Na2CO3
D.等物质的量浓度溶液的pH:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
一种检测驾驶员是否酒后驾车的仪器工作原理是:橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇具有还原性 ④乙醇是烃的含氧衍生物 ⑤乙醇可与羧酸在浓硫酸的作用下发生取代反应
A. ①③ B.②③
C. ②⑤ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2 +2H++2e一= HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
[选修5——有机化学基础] (15分)
止咳酮(F)具有止咳、祛痰作用。其生产合成路线如下:
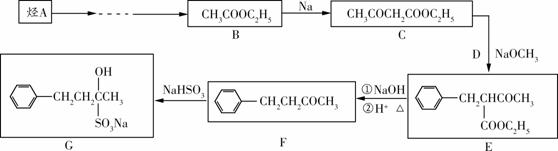
(1)已知烃A可以作为一个国家石油化工生产的标志,则A是________(填结构简式) ;由A合成B发生的化学反应类型有 (填字母)。
a.加成反应 b.酯化反应 c.氧化反应 d.消去反应 e.加聚反应
(2)F中含有的官能团名称为
(3)C的核磁共振氢谱中可能出现 组吸收峰;
(4)已知D为氯代烃,C生成E为取代反应,写出C+D→E的化学方程式 。
(5)1mol F与1mol H2加成后生成有机物M,满足下列条件的M的同分异构体有 种。
① 苯的二元取代物
② 1mol M能与含2mol Br2的浓溴水完全发生反应
写出取代基无支链的一种结构______________
(6)目前我国用粮食发酵生产丙酮(CH3COCH3)占较大比重。利用题给相关信息,以淀粉为原料,合成丙酮的流程图如下。请将虚线处过程补充完整。合成过程中无机试剂任选。

查看答案和解析>>
科目:高中化学 来源: 题型:
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL的N2O4气体(都已折算到标准状态),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于 ( )
A.8.64 B.9.20
C.9.00 D.9.44
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
 __(D)__+24NaClO3+12H2SO4===
__(D)__+24NaClO3+12H2SO4=== ClO2↑+
ClO2↑+ CO2↑+18H2O+
CO2↑+18H2O+ ________
________
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟用工业废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾
(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O]的操作流程如下:
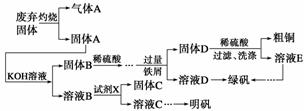
(1)试剂X是________(写化学式)。
(2)配平下列方程式
MnO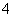 +____SO2+____H2O===____Mn2++____SO
+____SO2+____H2O===____Mn2++____SO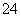 +____H+
+____H+
(3)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0 g 样品配成100 mL溶液,移取25.00 mL于锥形瓶中,用 1.000×10-1 mol·L-1的KMnO4标准溶液进行滴定(MnO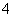 被还原为Mn2+)。
被还原为Mn2+)。
请回答下列问题:
①滴定时,KMnO4标准溶液应盛放在______________中(填仪器名称)。
②若到达滴定终点消耗KMnO4标准溶液的体积为25.00 mL,则该产品中铁元素的质量分数为_____ ___。
___。
查看答案和解析>>
科目:高中化学 来源: 题型:
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)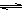 CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
① 一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)
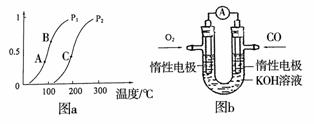
② 100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,反应达平衡的标志是: 。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4)= v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为 。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH = 。(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是: 、 、能连续工作。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com