
| ||
| △ |
| ||
| △ |
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
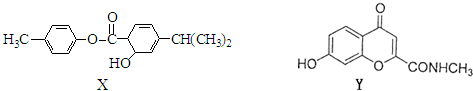
| A、1mol X与NaOH溶液反应,最多消耗2 mol NaOH |
| B、X、Y都有较强的水溶性 |
| C、X、Y都能使KMnO4溶液褪色 |
| D、X、Y的水解产物有可能发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加入NaOH溶液的体积 | pH | |
| ① | 0L | 2 |
| ② | 1L | 4 |
| ③ | 2L | 10 |
| ④ | 3L | 12 |
| c(Na+) | ||
c(P
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. | 现象:溶液变成黄色. 结论: |
| 步骤2: | 现象: 结论: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023 |
| B、一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8×6.02×1023 |
| C、100mL 1mol/L AlCl3与3mol/L NaCl的混合溶液中,Cl-的个数为0.6×6.02×1023 |
| D、含有非极性键的数目为6.02×1023的Na2O2与水充分反应,标况下产生O2 22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物(如图)的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物(如图)的说法正确的是( )| A、两种酸都能与溴水发生反应 |
| B、鞣酸分子与莽草酸分子相比多了两个碳碳双键 |
| C、1mol莽草酸完全燃烧消耗7mol O2 |
| D、等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com