
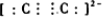 ,其中α键和π键数目之比为1:2.
,其中α键和π键数目之比为1:2.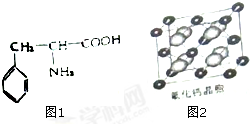
分析 (1)CaO与焦炭在电炉中加强热反应生成的,化学反应方程式为:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO;CaC2中含有化学键的类型为离子键和非极性共价键;C22-含有C≡C键,电子式为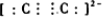 ;
;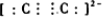 中含有1个σ和2个π;
中含有1个σ和2个π;
(2)MgO、CaO两者都是离子晶体,晶格能的大小不同,导致熔沸点的不同;
(3)苯丙氨酸是一种重要的氨基酸,其结构如图1所示,分子中第一电离能最大的原子是氮原子,价电子排布式是2s2sp3;苯环和羧基上的碳是sp2杂化,其余碳是sp3杂化;
(4)根据ρV=$\frac{M}{{N}_{A}}$计算相对分子质量.
解答 解:(1)CaO与焦炭在电炉中加强热反应生成的,化学反应方程式为:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO;CaC2中含有化学键的类型为离子键和非极性共价键;C22-含有C≡C键,电子式为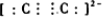 ,α键和π键数目之比为1:2,故答案为:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO;离子键和非极性共价键;
,α键和π键数目之比为1:2,故答案为:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO;离子键和非极性共价键;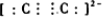 ;1:2;
;1:2;
(2)MgO、CaO两者都是离子晶体,镁离子的半径小钙离子的半径,因为氧化镁的晶格能大于氧化钙,所以MgO的熔点高于CaO的熔点,故答案为:氧化镁的晶格能大于氧化钙;
(3)苯丙氨酸是一种重要的氨基酸,其结构如图1所示,分子中第一电离能最大的原子是氮原子,价电子排布式是2s2sp3;苯环和羧基上的碳是sp2杂化,其余碳是sp3杂化,故答案为:2s2sp3;sp2、sp3;
(4)该晶胞中含有钙离子个数=$\frac{1}{8}$×8+$\frac{1}{2}$×6=4,根据一个晶胞的质量为ρV=$\frac{M}{{N}_{A}}$,Ca的摩尔质量在数值上和其相对分子质量是相等的,即M=ρVNA=$\frac{{a}^{3}ρ{N}_{A}}{4}$,故答案为:$\frac{{a}^{3}ρ{N}_{A}}{4}$.
点评 本题考查物质结构与性质,综合性强,涉及核外电子排布、分子结构与性质、晶格能、晶体结构与性质、杂化轨道、等电子体、晶胞计算等,侧重对主干知识的考查,需要学生熟练掌握基础知识,题目难度中等.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:解答题
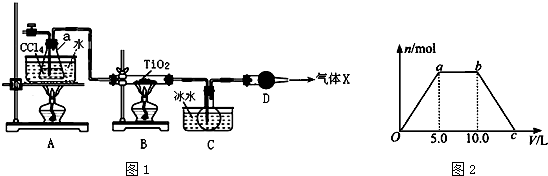
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑧ | B. | ④⑤⑦⑧ | C. | ③④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
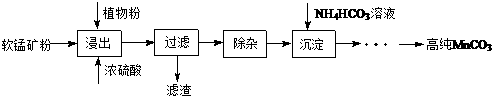
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冬季居民的家中用煤取暖 | B. | 城市和乡村大力开展植树造林 | ||
| C. | 工厂排放烟尘的烟囱加高 | D. | 将城市的固体废弃物运向农村倾倒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
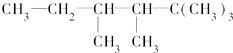
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
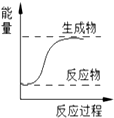
| A. | 金属钠与水的反应 | B. | 氢气燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl (固体)混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com