
| A. | 核内质子数为131 | B. | 核内中子数为131 | C. | 原子序数为53 | D. | 质量数为53 |
分析 元素符号左上角数字表示质量数、左下角数字表示质子数,所以该核素中质子数是53、质量数是131,中子数=质量数-质子数,原子中核外电子数等于质子数,据此分析解答.
解答 解:元素符号左上角数字表示质量数、左下角数字表示质子数,所以该核素中质子数是53、质量数是131,中子数=质量数-质子数=131-53=78,原子中核外电子数等于质子数=53,
A.质子数是53,故A错误;
B.中子数是78,故B错误;
C.原子序数是53,故C正确;
D.质量数是131,故D错误;
故选C.
点评 本题考查质子数、中子数、质量数、核外电子数之间的关系,明确这几个物理量之间的关系即可解答,知道元素符号周围各个方向上数字的含义,题目难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
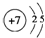 ,
,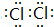 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
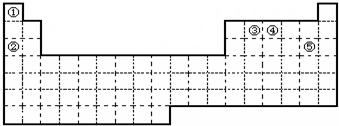
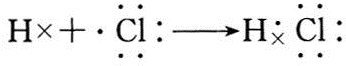 ;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程
;B与G形成离子化合物(填“离子”或“共价”),用电子式表示它的形成过程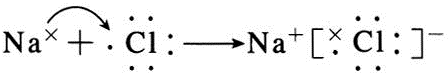 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
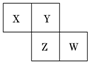 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| B. | 只由这四种元素不能组成有机化合物 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②H乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键(须指明加成产物是何物质)
,很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②H乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是加成产物CH3OH分子之间能形成氢键(须指明加成产物是何物质)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )
新型能源氢能的关键技术是储氢.如图装置可实现有机物的电化学储氢(忽略其它有机物),储氢装置的电流效率η=生成目标产物消耗的电子数/转移的电子总数×100%,则下列说法正确的是( )| A. | 该储氢装置的电流效率η=64.3% | |
| B. | D电极室发生的所有的电极反应为:C4H6+6H++6e-═C6H12 | |
| C. | B电极为电源的负极 | |
| D. | H+由D电极室移向E电极室 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com