
|
下列能被工业上采用做为冶炼金属的方法是 | |
| [ ] | |
A. |
电解熔融氯化钠制钠 |
B. |
电解NaCl的水溶液制钠 |
C. |
高温下用氢气还原氧化镁制镁 |
D. |
高温下用铝还原氧化铁制铁 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||








查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ)⑴已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ·mol-1
2H2(g)十O2(g)=2H2O(g):△H=-483.6kJ·mol-1
则N2(g)+3H2(g)![]() 2NH3(g)的△H= ▲ 。
2NH3(g)的△H= ▲ 。
⑵在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3) ▲ ;
②达到平衡时NH3的体积分数为 ▲ 。
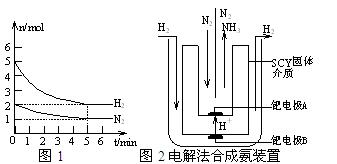
⑶近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 ▲ 。
Ⅱ)甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20molCH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。

(1)温度不变,缩小体积,增大压强,①的反应速率 ▲ (填“增大”、“减小”或“不变”),平衡向 ▲ 方向移动。
(2)反应①的△H1 ▲ 0(填“<”、“=”或“>”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八校高三第二次联考理综化学试卷(解析版) 题型:填空题
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:


根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是______________、氯碱工业的装置是_____________________。
(2)写出生产过程中X__________? Y___________ (填化学式)
(3)写出产生CuCl的化学方程式________________________________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是______________________________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是__________________________。
(6)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
_____________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2????? Fe2+ + Ce4+ = Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 |
空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市东城区示范校高三12月教学质量调研化学试卷(解析版) 题型:填空题
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCI4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.TiO2·xH2O高温分解得到TiO2。

①根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是 ,分离二者所采用的操作名称是 。
②Ⅲ中反应的化学方程式是 。
③如Ⅳ在实验室中完成,应将TiO2·xH2O放在 (填字母)中加热。

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2。H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”的部分原理。(夹持装置已略去)

①如缓慢通入22.4 L(已折算成标准状况)CO气体,结果NaOH溶液增重11 g,则CO的转化率为 。
②当CO气体全部通入后,还要按图示通一段时间空气,其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com