
| m |
| M |
| 18g |
| 18g/mol |
| 1mol×2 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
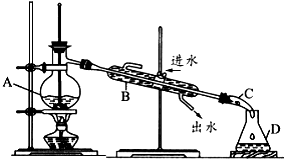
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液的pH一定等于7 |
| B、如果混合溶液的pH大于7,则碱一定为弱碱 |
| C、如果碱是强碱,则pH一定大于7 |
| D、如果酸是强酸,则pH一定小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
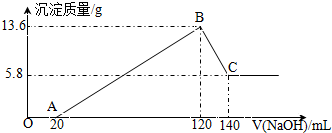 将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图.回答下列问题:
将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
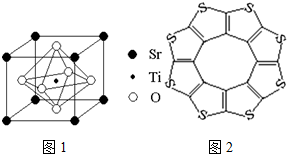 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节.| C-S | C=S | C16S8中碳硫键 | |
| 键长/pm | 181 | 155 | 176 |
查看答案和解析>>
科目:高中化学 来源: 题型:
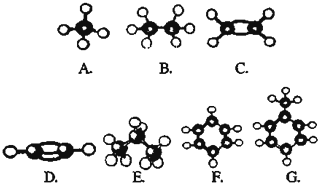
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com