
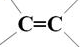 、-COOH.
、-COOH. .
. 的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.
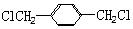
的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种. 分析 由CH2=CH-CH=CH2与HOCH2CH=CHCH2OH,可知CH2=CH-CH=CH2可以与溴发生1,4-加成反应生成BrCH2CH=CHCH2Br,再在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2CH=CHCH2OH,HOCH2CH=CHCH2OH与HCl发生加成反应生成B为HOCH2CH2CHClCH2OH,(4)中F可以连续发生氧化反应,则反应④为卤代烃的水解反应,故F为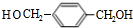 ,H为
,H为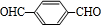 ,J为
,J为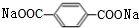 ,K为
,K为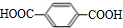 .F与E发生缩聚反应得到G,故E中含有羧基,则B发生氧化反应生成C为HOOCCH2CHClCOOH,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D为NaOOCCH=CHCOONa,D酸化得到E为HOOCCH=CHCOOH,E与F发生缩聚反应得到G为
.F与E发生缩聚反应得到G,故E中含有羧基,则B发生氧化反应生成C为HOOCCH2CHClCOOH,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D为NaOOCCH=CHCOONa,D酸化得到E为HOOCCH=CHCOOH,E与F发生缩聚反应得到G为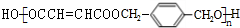 ,以此解答该题.
,以此解答该题.
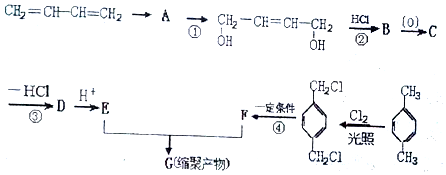
解答 解:(1)E为HOOCCH=CHCOOH,所含官能团的结构简式为: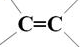 、-COOH,故答案为:
、-COOH,故答案为: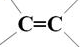 、-COOH;
、-COOH;
(2)反应①发生卤代烃的水解反应,属于取代反应,故答案为:取代反应;
(3)反应③是HOOCCH2CHClCOOH在氢氧化钠醇溶液、加热条件下发生消去反应生成NaOOCCH=CHCOONa,
故答案为:氢氧化钠醇溶液、加热;
(4)E+F→G的反应方程式为: ,
,
故答案为: ;
;
(5)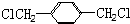 的同分异构体中含有苯环,且苯环上有三个取代基,若为2个-Cl、-CH2CH3时,2个-Cl有邻、间、对3种位置,对应的-CH2CH3分别有2种、3种、1种,若为-Cl、-CH2Cl、-CH3时,-Cl、-CH2Cl有邻、间、对3种位置,对应的-CH3分别有4种、4种、2种,故共有16种,
的同分异构体中含有苯环,且苯环上有三个取代基,若为2个-Cl、-CH2CH3时,2个-Cl有邻、间、对3种位置,对应的-CH2CH3分别有2种、3种、1种,若为-Cl、-CH2Cl、-CH3时,-Cl、-CH2Cl有邻、间、对3种位置,对应的-CH3分别有4种、4种、2种,故共有16种,
故答案为:16.
点评 本题考查有机物的推断与合成,为高频考点,侧重考查学生的分析能力,充分利用合成路线中有机物的结构,采取正、逆推法相结合进行推断,(5)中注意利用定二移一法确定同分异构体数目,(4)为易错点,学生对常见橡胶不清楚,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何气体单质在标准状况下体积约为22.4L,则一定含有2NA个原子 | |
| B. | 常温常压下,22g氧气和26g臭氧所含氧原子总数为3NA | |
| C. | 常温常压下,22.4LH2O中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3molCO2中含有氧原子数0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
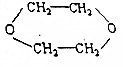 ,写出各步反应的化学方程式(一定要注明反应条件,有机物一定要写结构简式)(提示:电解食盐水可得NaOH,Cl2和H2)
,写出各步反应的化学方程式(一定要注明反应条件,有机物一定要写结构简式)(提示:电解食盐水可得NaOH,Cl2和H2)查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
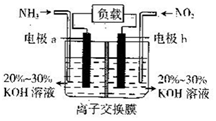 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示.下列说正确是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减少环境污染,又能充分利用化学能,装置如图所示.下列说正确是( )| A. | 电流从电极a经过负载后流向电极b | |
| B. | 为使电池持续放电,离子交换膜只允许阴离子通过 | |
| C. | 电极a的电极反应式为2NH3-6e-=N2+6H- | |
| D. | 室温下,当有4.48 L NO2被处理时,转移电子为0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,Cu(OH)2在水中的溶度积比其在 Cu(NO3)2溶液中的大 | |
| B. | 一定温度下,将 0.10mol•L-1的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2属于一元弱酸,则H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+OH-═H2PO2-+H2O | |
| D. | 常温下,NaHS溶液中:c(H+)+c(H2S)+c(Na+)=c(S2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾、氯化铁晶体可用于净水 | |
| B. | 实验室通常可使用热的纯碱溶液去除油污 | |
| C. | 实验室配制FeCl3溶液时可加入少量盐酸 | |
| D. | 直接加热CuCl2溶液能得到CuCl2固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com