
| A、构成该电池的正极和负极必须是两种活性不同的金属 |
| B、充电时有CH3OH生成的电极为阴极 |
| C、放电时电解质溶液的pH逐渐增大 |
| D、充电时每生成1 mol CH3OH转移12 mol电子 |
 2CO32-+6H2O,放电时消耗氢氧根离子,则电解质溶液的pH逐渐减小,故C错误;
2CO32-+6H2O,放电时消耗氢氧根离子,则电解质溶液的pH逐渐减小,故C错误; 2CO32-+6H2O,每生成2molCH3OH转移12mol电子,则每生成1molCH3OH转移6mol电子,故D错误.
2CO32-+6H2O,每生成2molCH3OH转移12mol电子,则每生成1molCH3OH转移6mol电子,故D错误.

科目:高中化学 来源: 题型:
| A、一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B、一定条件下,乙醇可发生消去反应,甲醇也可发生消去反应 |
| C、标准状况下,22.4L乙烷和丙烯的混合物,完全燃烧生成3 mol H2O |
| D、在光照作用下,2,2-二甲基丙烷与Br2反应其一溴取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
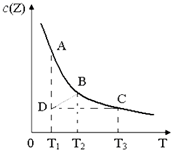 已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )
已知在一密闭容器中存在如下化学平衡:X(g)+3Y(g)?2Z(g),其中c(Z)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法中正确的是( )| A、B点对应的反应速率大于C点对应的反应速率 |
| B、状态A的c(Y)大于状态D c(Y) |
| C、反应X(g)+3Y(g)?2Z(g)的△H<0 |
| D、其他条件不变,缩小容器的体积,平衡可由D点移动到B点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醛 | B、二氧化碳 |
| C、一氧化碳 | D、甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、有BaSO4生成 |
| B、有BaSO3生成 |
| C、同时有BaSO4和BaSO3生成 |
| D、无明显现象发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煅烧粉碎的黄铁矿矿石有利于SO2的生成 |
| B、硫酸生产中用98%的硫酸吸收SO3,而不用H2O或稀硫酸吸收SO3 |
| C、加入催化剂有利于氨的合成 |
| D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、铅蓄电池使用一段时间后要添加硫酸 |
| B、电池充电时,阴极反应为:Pb-2e-+SO42-═PbSO4 |
| C、电池充电时,电池正极应和电源的正极相连接 |
| D、电池放电时,电池正极周围溶液pH不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com