

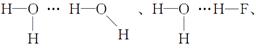 H—O—H…F—H共四种。
H—O—H…F—H共四种。 =6,C60处于晶胞顶点和体心:8×
=6,C60处于晶胞顶点和体心:8× +1=2。故K原子和C60分子的个数比为:6∶2=3∶1。
+1=2。故K原子和C60分子的个数比为:6∶2=3∶1。

 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源:不详 题型:填空题
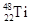 和
和 两种原子,它们互称为 ,钛基态原子的电子排布式为 ;
两种原子,它们互称为 ,钛基态原子的电子排布式为 ;
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

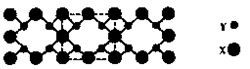
| A.该晶体属于分子晶体 |
| B.此晶体的硬度比金刚石还大 |
| C.晶体的化学式是X3Y4 |
| D.晶体熔化时破坏共价键 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.分子中含有氢键 |
| B.属于非极性分子 |
| C.含有4个σ键和1个π键 |
| D.该氢化物分子中,②原子采用sp2杂化 |
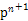 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。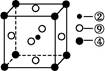
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为 (填最简整数比),写出该分子中所有碳原子的杂化方式 。
CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为 (填最简整数比),写出该分子中所有碳原子的杂化方式 。  为碳原子,
为碳原子, 为硅原子)。每个碳原子周围与其距离最近的硅原子有 个。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。
为硅原子)。每个碳原子周围与其距离最近的硅原子有 个。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为 (用含a、b的式子表示)。 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.极性键 | B.离子键 | C.非极性键 | D.配位键 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O | 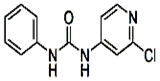 | 白色结晶粉末 | 170~172℃ | 易溶于水 |
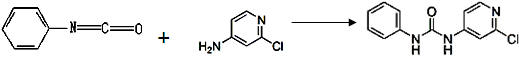
| | X | Y | Z |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
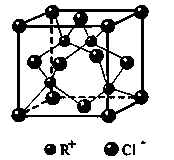
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com