
���и���Һ�У��������ʵ���Ũ�ȹ�ϵ��ȷ����
A��0.1 mol/L Na2CO3��Һ��c(OH��)��c(HCO3��)��c(H��)��2c(H2CO3)
B��0.1 mol/L NH4Cl��Һ��c(NH4�� )��c(Cl��)
C�����������Һ�м����������ᣬ�õ������Ի����Һ��
c(Na��)��c(CH3COO��)��c(H��)��c(OH��)
D������������Һ�еμ�ϡ����õ���pH��5�Ļ����Һ��c(Na��)��c(NO3��)

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л������У�ͬʱ�������Ӽ������Թ��ۼ����ǣ�
A. NaOH B. H2O2 C. HCl D. NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ����
A����pH��2�������pH��2�Ĵ���������ϣ���Ϻ���Һ��pH��2
B��HA����HB�����ѵ��룬��NaHA��Һ��pHһ����NaHB��Һ�Ĵ�
C���ڱ��Ͱ�ˮ�м���ͬŨ�ȵİ�ˮ��ƽ�������ƶ�
D��ij�¶��£�Ba(OH)2��Һ�У�Kw��10��12��pH��8�ĸ���Һ�м�������pH��4�����ᣬ�����Һ��pH��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ����٤��������ֵ������˵����ȷ����
A���ڸ��¸�ѹ�£�28 gN2��6g H2��ַ�Ӧ����NH3�ķ�����Ϊ2NA
B��1mol/LFeCl3 ��Һ������Fe3+����ĿС��NA
C�������£�1L pH=12��Ba(OH)2 ��Һ�к�OH������ĿΪ2NA
D��23g NO2��N2O4�Ļ�������к��е�ԭ����Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ܱ������У����ڷ�Ӧ��N2(g)+3H2 2NH3(g)���ڷ�Ӧ��ʼʱN2��H2�ֱ�Ϊ10mol��30mol�����ﵽƽ��ʱ��N2��ת����Ϊ30%������NH3Ϊ��ʼ��Ӧ���Ӧ������������Ӧ��ͬʱ����ʹ��ﵽƽ��ʱ���ɷֵİٷֺ�����ǰ����ͬ����NH3����ʼ���ʵ�����NH3��ת������ȷ����
2NH3(g)���ڷ�Ӧ��ʼʱN2��H2�ֱ�Ϊ10mol��30mol�����ﵽƽ��ʱ��N2��ת����Ϊ30%������NH3Ϊ��ʼ��Ӧ���Ӧ������������Ӧ��ͬʱ����ʹ��ﵽƽ��ʱ���ɷֵİٷֺ�����ǰ����ͬ����NH3����ʼ���ʵ�����NH3��ת������ȷ����
A. 20mol��70�� B. 20mol��30�� C. 40mol��35�� D. 10mol��50��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ߡ������־���ҹ��ĺ�����ҵ�������µ�ƪ�¡�
��1�����������Ҫ���ܵ�ȼ�ϣ�������������������������(N2H4)��Ϊȼ�ϣ���ҵ�����õ������������Ժϳɰ��������ֿ��Խ�һ���Ʊ������ȡ�
��֪ N2(g)+2O2(g)=2NO2(g) ��H =+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H =�� 534.0kJ/mol
NO2(g)  1/2N2O4(g) ��H = ��26.35kJ/mol
1/2N2O4(g) ��H = ��26.35kJ/mol
��д����̬��������̬������������ȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ �� ��
���ð��ʹ������ư�һ�����ʵ���֮�Ȼ�Ϸ�Ӧ�������������÷�Ӧ�Ļ�ѧ����ʽΪ �� ��
��2����ͼ��ij�ռ�վ����ת��ϵͳ�ľֲ�ʾ��ͼ������ȼ�ϵ�ز�����������Ϊ���Һ��ȼ�ϵ�طŵ�ʱ�ĸ�����ӦʽΪ �� ��
���ij��ʱ�������������й��ռ���33.6 L���壨������ɱ�״��������ö�ʱ����ˮ���ϵͳ��ת�Ƶ��ӵ����ʵ���Ϊ �� mol��
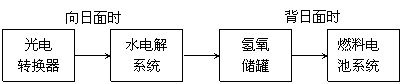 |
��3�������˺���������̬ϵͳ�У�����Ҫ������ȥCO2����Ҫ���ṩ�����O2��ij�ֵ绯ѧװ�ÿ�ʵ������ת����2CO2 = 2CO + O2��CO������ȼ�ϡ�
��֪�÷�Ӧ��������ӦΪ��4OH����4e��= O2�� + 2H2O����������ӦʽΪ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й����л�ѧ��û�б��ƻ�����
A��ˮ�������� B��ˮ���ȵ�1500�濪ʼ�ֽ�
C�����ڵ��Ȼ��� D��NaOH����ˮ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ���������ֵ������˵����ȷ���� (����)��
A�������£�4 g CH4����NA��C��H���ۼ�
B��1 mol Fe ��������ϡHNO3��Ӧ��ת��2NA������
C��1 L 0.1 mol��L��1 NaHCO3��Һ�к���0.1NA ��HCO3��
D�����³�ѹ�£�22.4 L��NO2��CO2������庬��2NA��Oԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
MnO2��һ����Ҫ�������ܲ��ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�о���ѧϰС������˽���MnO2(���н϶��MnO��MnCO3)��Ʒת��Ϊ��MnO2��ʵ�飬���������£�

(1)�ڢٲ���ϡH2SO4ʱ����MnO2��Ʒ�е�________(д��ѧʽ)ת��Ϊ���������ʡ�
(2)�ڢڲ���Ӧ�����ӷ���ʽ�� ________��
________�� ClO3����
ClO3���� ________===
________=== MnO2����
MnO2���� Cl2����
Cl2���� ______
______ ��
��
(3)�ڢ۲������������������������̨(����Ȧ)��________��________��________����֪�����õ��Ĺ�������NaClO3��NaOH����һ��������________(д��ѧʽ)��
(4)����MnO2��Ʒ������Ϊ12.69 g���ڢٲ���Ӧ�����˵õ�8.7 g MnO2�����ռ���0.224 L CO2(��״����)�����ڵڢڲ���Ӧ��������Ҫ________mol NaClO3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com