
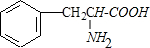 .
. .
.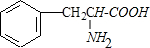 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$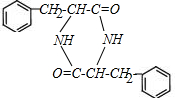 +2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).
+2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).分析 氧元素的质量分数约为19.4%,M的相对分子质量介于150与200之间,若相对分子量为150时,含有氧原子数为$\frac{150×19.4%}{16}$≈1.81,若M的相对分子量为200时,含有氧原子数为$\frac{200×19.4%}{16}$≈2.425,所以M分子中含有2个O原子,则M的相对分子量为:$\frac{16×2}{19.4%}$=165;碳元素的质量分数约为65.5%,则M分子中含有C原子数为:$\frac{165×65.5%}{12}$=9;在M分子碳、氧原子个数之和等于氢原子数,则M分子中含有H原子数为:9+2=11,M中含有N原子数为:$\frac{165-12×9-1×11-16×2}{14}$=1,所以M的分子式为:C9H11O2N;进一步测定M只含有一个侧链,M分子含-NH2,M能和氢氧化钠溶液反应,M分于中官能团连接在同一个碳原子上,且不含甲基,则M分子中含有羧基,其结构简式为: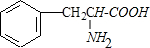 ,据此进行解答.
,据此进行解答.
解答 解:(1)氧元素的质量分数约为19.4%,M的相对分子质量介于150与200之间,若相对分子量为150时,含有氧原子数为$\frac{150×19.4%}{16}$≈1.81,若M的相对分子量为200时,含有氧原子数为$\frac{200×19.4%}{16}$≈2.425,所以M分子中含有2个O原子,则M的相对分子量为:$\frac{16×2}{19.4%}$=165;碳元素的质量分数约为65.5%,则M分子中含有C原子数为:$\frac{165×65.5%}{12}$=9;在M分子碳、氧原子个数之和等于氢原子数,则M分子中含有H原子数为:9+2=11,M中含有N原子数为:$\frac{165-12×9-1×11-16×2}{14}$=1,所以M的分子式为:C9H11O2N,
故答案为:C9H11O2N;
(2)M的分子式为C9H11O2N,M为芳香族化合物,则M分子中一定含有苯环;进一步测定M只含有一个侧链,M分子含-NH2,M能和氢氧化钠溶液反应,M分于中官能团连接在同一个碳原子上,且不含甲基,则M分子中含有羧基,其结构简式为: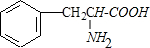 ,
,
故答案为: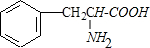 ;
;
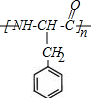
(3)M的结构简式为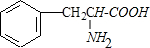 ,其分子中含有氨基和羧基,在一定条件下能够发生缩聚反应生成高聚物:
,其分子中含有氨基和羧基,在一定条件下能够发生缩聚反应生成高聚物: ,
,
故答案为: ;
;
(4)M在一定条件下自身发生反应生成的产物分子含3个六元环,说明两分子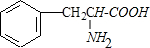 发生成成肽反应生成
发生成成肽反应生成 ,反应的化学方程式为:2
,反应的化学方程式为:2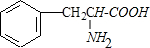 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O;
+2H2O;
M分子中含有羧基,能够与乙醇发生酯化反应,该反应也属于取代反应,
故答案为:2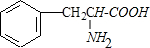 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O;酯化反应(取代反应);
+2H2O;酯化反应(取代反应);
(5)M为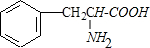 ,W是M的同分异构体,W具有下列结构和性质:①苯环上只有一个侧链;②既能发生银镜反应,又能发生水解反应,则W分子中含有醛基和酯基;而M中只含有2个O原子,则W为甲酸酯;③含-NH2,则满足条件的W苯环侧链有:-CH(NH2)CH2OOCH、-C(NH2)(CH3)-OOCH、-C(CH2NH2)OOCH,总共有3种结构,
,W是M的同分异构体,W具有下列结构和性质:①苯环上只有一个侧链;②既能发生银镜反应,又能发生水解反应,则W分子中含有醛基和酯基;而M中只含有2个O原子,则W为甲酸酯;③含-NH2,则满足条件的W苯环侧链有:-CH(NH2)CH2OOCH、-C(NH2)(CH3)-OOCH、-C(CH2NH2)OOCH,总共有3种结构,
故答案为:3.
点评 本题考查了有机推断,题目难度中等,正确推断M的分子式、结构简式为为解答关键,注意熟练掌握常见有机物结构与性质,试题充分考查了学生分析、理解能力及逻辑推理能力.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题
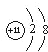 阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.
阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
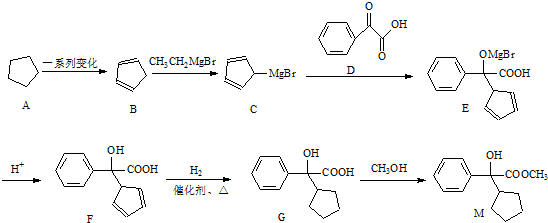
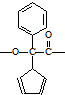
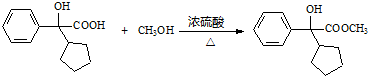 .
.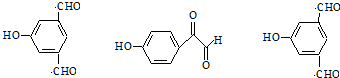 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | CaCO3 | C. | H2O | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
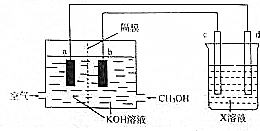
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
| 实验序号 | 温度/℃ | 压强/kPa | v(CH4)/mol•L-1•s-1 | v(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Na+、Fe3+、NO3-、OH- | |
| B. | 滴加酚酞溶液呈红色:K+、NO3-、H+、HCO3- | |
| C. | 0.1 mol•L-1 CaCl2的溶液中:Na+、K+、CO32-、SO42- | |
| D. | 能与Mg反应生成H2的溶液:Na+、K+、SO42-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
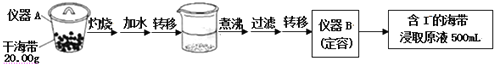
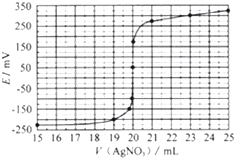
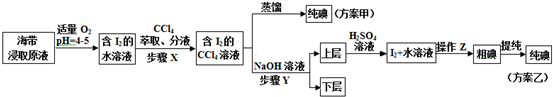
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com