
下图为常温下向25 mL 0.1 mol·L-1 MOH溶液中逐滴滴加0.2 mol·L-1HA溶液过程中溶液pH的变化曲线.

回答下列问题:
(1)上图能确定MOH为________(“强”或“弱”)碱,理由是________.
(2)上图能确定HA为________(“强”或“弱”)酸,理由是________.
(3)在D点时,溶液中c(A-)+c(HA)________2c(M+).(填“>”、“<”或“=”)
科目:高中化学 来源: 题型:
| 离子液体 | 溶解条件 | 溶解度(质量%) |
| [C4min]Cl | 加热到100℃ | 10% |
| [C4min]Cl | 微波加热 | 25%,清澈透明 |
| [C4min]Br | 微波加热 | 5%~7% |
| [C4min]SCN | 微波加热 | 5%~7% |
| [C4min][BF4] | 微波加热 | 不溶解 |
| [C4min][PF4] | 微波加热 | 不溶解 |
| [C6min]Cl | 微波加热 | 5% |
| [C8min]Cl | 微波加热 | 微溶 |

 假设在[C4min]Cl里溶解了25%的聚合度n=500的纤维素,向该体系添加1.0%(质量)的水,占整个体系的物质的量分数为多少?假设添水后纤维素全部析出,析出的纤维素的物质的量分数为多大?
假设在[C4min]Cl里溶解了25%的聚合度n=500的纤维素,向该体系添加1.0%(质量)的水,占整个体系的物质的量分数为多少?假设添水后纤维素全部析出,析出的纤维素的物质的量分数为多大?查看答案和解析>>
科目:高中化学 来源: 题型:
(1)经测定,A2D2的水溶液呈弱酸性。请写出第一步的电离方程式。
(2)用甲和单质D2可设计呈燃料电池,若电解质溶液为浓KOH溶液,则正极的电极反应式为______________________________。
(3)
(4)单质F与E的最高价氧化物的水化物的溶液反应的离子方程式是_______________。
(5)常温下向25 mL 0.1 mol·L-1丙溶液中逐滴滴加0.1 mol·L-1丁溶液,滴加过程中混合溶液pH的变化曲线如下图所示:

①图中m点由水电离出的OH-的物质的量浓度为___________________;
②p点时,丙溶液和丁溶液恰好完全反应,则p点溶液中各种离子浓度由大到小的顺序为_____________________。
查看答案和解析>>
科目:高中化学 来源:2012届广东省广州六校高三第二次联考化学试卷 题型:填空题
(12分)
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图: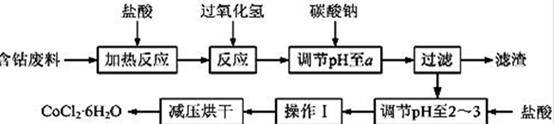
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |

 。
。查看答案和解析>>
科目:高中化学 来源:2010-2011学年云南省高三第二次毕业生复习统一检测(理综)化学部分 题型:填空题
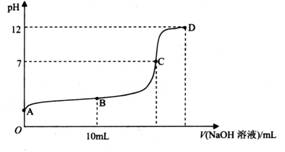
常温下,用 0.1000 mol L-1NaOH 溶液滴定 20.00 ml 0.1000 mol.L-1CH3COOH溶液,所得滴定曲线如下图所示。
请回答:
(1) 有人认为,C点时NaOH与CH3COOH恰好完全反应,这种看法是否正确______?(选填“是”或“否”),理由是________________________;
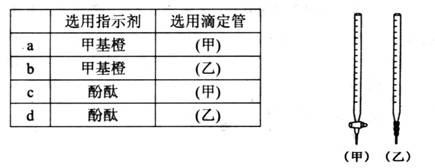
(2) 关于该滴定实验,从下列选项中选出最恰当的一项____ (选填字母);
(3) 在B点时,溶液中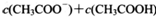 ________
________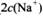 (选填“>”、“<”或“=”);
(选填“>”、“<”或“=”);
(4) 在A〜D区间内,下列大小关系可能存在的是________;
①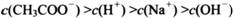
③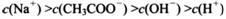
④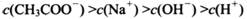
(5) 若向该醋酸溶液中加入少量的醋酸钠晶体,则溶液的pH会____(选填“增大”、“减小”或“不变”);
(6) 常温下,用该NaOH溶液滴定25.00 mL—定浓度的某稀H2SO4溶液,达到滴定终点时消耗NaOH溶液的体积为25.00 mL,则该稀H2SO4溶液的pH=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com