
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入A(体积不变),则B的转化率_________。
(4)若降低温度,则平衡时B、C的浓度之比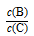 将______ ___。
将______ ___。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,维持容器内压强不变,充入氖气时,混合物颜色____ (填“变深”“变浅”或“不变”)。
(1) > (2)减小 (3) 增大 (4) 增大 (5) 不变 (6)变深
【解析】
试题分析:(1)达到平衡后,当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和,故m+n>p。
(2)增大压强时,平衡向着方程式中气体的计量数之和增大的反应方向移动,即向着正反应方向移动,则A的质量分数减小。
(3)若加入A(体积不变),平衡向着正反应方向移动,则B的转化率增大。
(4)正反应放热,若降低温度,平衡正向移动,C的物质的量增多,B的物质的量减小,所以二者的浓度比值将增大。
(5)催化剂对化学平衡移动没有影响,所以若加入催化剂,该反应平衡时气体混合物的总物质的量不变。
(6)若B是有色物质,A、C均为无色物质,维持容器内压强不变,充入氖气时,反应体系气体的压强减小,化学平衡向气体系数增大的方向移动,即向逆反应方向移动,所以化合物颜色变深。
考点:本题考查外界条件对化学平衡移动的影响。


科目:高中化学 来源:2014-2015学年甘肃甘谷县第一中学高一上学期第一次月考化学试卷(解析版) 题型:实验题
(每空2分,共12分)现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
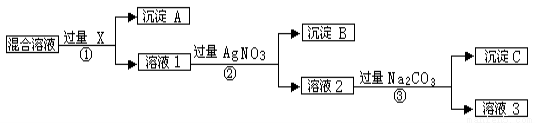
请回答下列问题:
(1)写出实验流程中下列物质的化学式: 试剂X : ,沉淀A: ,沉淀B: 。
(2)上述实验流程中加入过量的Na2CO3的目的是
(3)按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
已知298 K时,合成氨反应N2(g)+3H2(g)?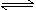 2NH3(g) ΔH=-92.0 kJ·mol-1,将此
2NH3(g) ΔH=-92.0 kJ·mol-1,将此
温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反
应放出的热量为(假定测量过程中没有能量损失) ( )
A.一定小于92.0 kJ B.一定大于92.0 kJ
C.一定等于92.0 kJ D.无法确定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:选择题
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3= K2O+5Na2O+16N2↑。若氧化产物比还原产物多1. 75 mol,则下列判断正确的是
A.生成40.0 L N2(标准状况)
B.有0. 250 mol KNO3被氧化
C.转移电子的物质的量为1. 75mol
D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:选择题
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
A.①③⑥⑧ B.③⑦⑧ C.②⑤⑥⑦ D.①④⑧
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
某温度下在容积不变的密闭容器中发生如下反应:2SO2+O2 2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
2SO3(g),若开始时只充入2 molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为
A.20% B.40% C.50% D.60%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
下列与化学反应能量变化相关的叙述正确的是( )
A.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
B.等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同
C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.氢气的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g) + O2(g) ΔH=+ 571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省衡阳市高二上学期期中考试化学试卷(解析版) 题型:填空题
(14分)25℃时0.1 mol/L的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:
甲认为:醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;
乙认为:醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH.(已知25℃时,CH3COONH4溶液呈中性).
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)加入(1)中物质后,若甲的解释正确,溶液的pH应________;若乙的解释正确,溶液的pH应________;(填“增大”“减小”或“不变”).
(3)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液.判断:
①溶液中共有________种粒子;
②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=________mol.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com