

���� ��1�������еõ������ʵ�����CO��CO2��SԪ�ر���ԭ�õ�Na2S��
��2����ˮ�ٽ�����ˮ�⣬�ü�Һ��������ˮ�⣻
��3������Cu��OH��2�ܶȻ������c��Cu2+��������CuS���ܶȻ����c��S2-����
��4��Cu��+2�۱�Ϊ+1�ۣ��õ��ӣ�����������ӦʽΪ��2Cu2++2e-+H2O=Cu2O��+2H+��
��� �⣺��1�������еõ������ʵ�����CO��CO2��SԪ�ر���ԭ�õ�Na2S����Ӧ����ʽΪ��3Na2SO4+8C$\frac{\underline{\;\;��\;\;}}{\;}$3Na2S+4CO2��+4CO����
�ʴ�Ϊ��3Na2SO4+8C$\frac{\underline{\;\;��\;\;}}{\;}$3Na2S+4CO2��+4CO����
��2��Na2S��ǿ�������Σ�ˮ�����Һ�Լ��ԣ����Ȼ�ٽ�S2-ˮ�⣬���Ӽ������������ˮ�⣬
�ʴ�Ϊ����ˮ�ܴٽ�Na2Sˮ�⣬��ϡ�������Na2Sˮ�⣻
��3����ҺpH=4������Һ��c��OH-��=10-10 mol/L������Cu��OH��2�ܶȻ��ɵ�c��Cu2+��=$\frac{2.2��1{0}^{-20}}{��1{0}^{-10}��^{2}}$mol/L=2.2 mol/L������CuS���ܶȻ��ɵ�c��S2-��=$\frac{8.8��1{0}^{-36}}{2.2}$mol/L=4.0��10-36mol/L��
�ʴ�Ϊ��4.0��10-36mol/L��
��4���������Cu2O��CuԪ����+2�۱�Ϊ+1�ۣ��õ��ӣ�������ԭ��Ӧ����Cu2O���������ɣ������缫��ӦʽΪ��2Cu2++2e-+H2O=Cu2O��+2H+�����ڷ�Ӧ����H+���ɣ�������Һ��pH���ͣ�
�ʴ�Ϊ���������ͣ�2Cu2++2e-+H2O=Cu2O��+2H+��
���� ���⿼���Ʊ���������ƣ���Ŀ�Ѷ��еȣ��漰������ѧ��ҵ���Բ����ķ������ۡ��ܶȻ����㡢���ԭ����֪ʶ�����ؿ���ѧ��������ϵʵ�ʵ��������Ķ���ȡ��Ϣ��������֪ʶǨ��Ӧ�ã���ȷʵ��Ŀ��Ϊ���ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
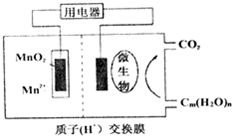 ������ͼ����ȼ�ϵ�ؽṹʾ��ͼ��˵����
������ͼ����ȼ�ϵ�ؽṹʾ��ͼ��˵����| A�� | �� | B�� | �٢� | C�� | �٢� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| A | B | C |
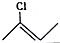 |  |  |
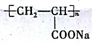 ��
��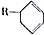 �ṹ��D���ܵĽṹ��4�֣�д��
�ṹ��D���ܵĽṹ��4�֣�д��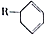 ��Cl2����1��4-�ӳɷ�Ӧ�Ļ�ѧ����ʽ��
��Cl2����1��4-�ӳɷ�Ӧ�Ļ�ѧ����ʽ��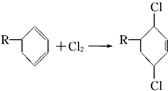 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 A��B��C��D��E����Ԫ�أ���λ��Ԫ�����ڱ���ǰ�����ڣ����ǵĺ˵���������ӣ��Һ˵����֮��Ϊ57��Bԭ�ӵ�L��p�������2�����ӣ�C��ԭ�Ӻ���������δ�ɶԵ��ӣ�D��Bԭ�ӵļ۵�������ͬ��Eԭ�ӵ�K�������������������֮��Ϊ2��1����d�������ȫ����״̬����ش��������⣺
A��B��C��D��E����Ԫ�أ���λ��Ԫ�����ڱ���ǰ�����ڣ����ǵĺ˵���������ӣ��Һ˵����֮��Ϊ57��Bԭ�ӵ�L��p�������2�����ӣ�C��ԭ�Ӻ���������δ�ɶԵ��ӣ�D��Bԭ�ӵļ۵�������ͬ��Eԭ�ӵ�K�������������������֮��Ϊ2��1����d�������ȫ����״̬����ش��������⣺ ��Y��Dԭ�ӵ��ӻ��������Ϊsp3�ӻ���C��A�γɵij���������ķ��ӹ���Ϊ�����Σ�
��Y��Dԭ�ӵ��ӻ��������Ϊsp3�ӻ���C��A�γɵij���������ķ��ӹ���Ϊ�����Σ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ݻ�Ϊijһ�̶�ֵ������ϵ��ѹǿ���ٷ����仯ʱ˵���ﵽ��ѧƽ��״̬ | |
| B�� | ���������淴Ӧ�ﻯѧƽ��״̬��ƽ����ϵ��ѹ����С�ݻ��������������䣩���������������ƽ��Ħ����������С | |
| C�� | ���������淴Ӧ�ﵽ��ѧƽ��״̬�������¶ȣ������������䣩��ϵ��ɫ�����Q��0 | |
| D�� | ��������������̸�ƽ����ϵ��ѹ�������ݻ��������������䣩���������N2O4�IJ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
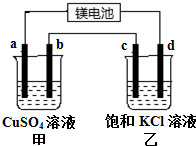 ��һ��þ���ε�أ���ӦΪ��xMg+Mo3S4$?_{���}^{�ŵ�}$MgxMo3S4�����Ӽס���װ�ý��е�⣮��ͼ��ʾ��a��b��c��Ϊʯī�缫��dΪFe�缫�����ʱd��������ų�������˵������ȷ���ǣ�������
��һ��þ���ε�أ���ӦΪ��xMg+Mo3S4$?_{���}^{�ŵ�}$MgxMo3S4�����Ӽס���װ�ý��е�⣮��ͼ��ʾ��a��b��c��Ϊʯī�缫��dΪFe�缫�����ʱd��������ų�������˵������ȷ���ǣ�������| A�� | ��װ����a�ĵ缫��ӦΪ4OH--4e-�TO2��+2H2O | |
| B�� | �ŵ�ʱþ��������ĵ缫��ӦΪ Mo3S4+2xe-�TMo3S42x- | |
| C�� | ��d������0.56 L����״��������ʱ��b������3.2 g | |
| D�� | þ��طŵ�ʱ���׳��е�SO42-����a�缫 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �� pH Ϊ 6.37 �� 10.25 ʱ����Һ�� c��H2CO3��=c��HCO3-��=c��CO32-�� | |
| B�� | ��Ӧ HCO3-+H2O?H2CO3+OH-��ƽ�ⳣ��Ϊ 10-7.63 | |
| C�� | 0.1 mol•L-1NaHC2O4��Һ�� c��HC2O4-��+2c��C2O42-��+c��H2C2O4��=0.1 mol•L-1 | |
| D�� | �� Na2CO3��Һ�м�������������Һ��������Ӧ��CO32-+H2C2O4=HCO3-+HC2O4- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �����Ǿ���ṹ�еĻ����ṹ��Ԫ | |
| B�� | ���ݾ���IJ�ͬ�����������Ƕ�����״�ļ����� | |
| C�� | ����һ�㶼��ƽ�������� | |
| D�� | ���������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com