
| A.钢铁与电源的正极连接,钢铁可被保护 |
| B.钢铁发生析氢腐蚀时,负极反应为:Fe-3e-=Fe3+ |
| C.与铜质水龙头连接的钢质水管不易发生腐蚀 |
| D.钢铁在潮湿的空气中能发生电化学腐蚀 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:单选题
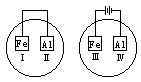
| A.II和Ⅳ | B.Ⅱ和Ⅲ | C.Ⅰ和Ⅲ | D.Ⅰ和Ⅳ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
业的基础,请回答钢铁腐蚀与防护过程中的有关问题。 放入
放入 盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式
盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式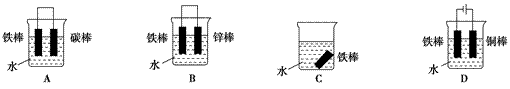
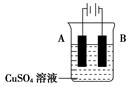
 因
因查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 LiFePO4,含Li+导电固体为电解质。下列有关LiFePO4电池说法
LiFePO4,含Li+导电固体为电解质。下列有关LiFePO4电池说法| A.可加入硫酸以提高电解质的导电性 |
| B.充电时LiFePO4既发生氧化反应又发生还原反应 |
| C.充电过程中,电池正极材料的质量减少 |
| D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 4SiHCl3(g)
4SiHCl3(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
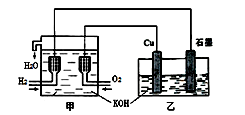
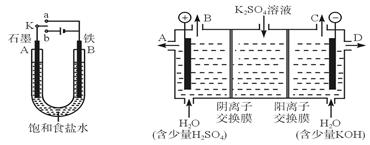
| A.乙中Cu电极的电极反应式是: 2Cu + 2OH-→ Cu2O+ H2O+ 2e- |
| B.甲中通入氢气的电极为正极 |
| C.乙中阴离子向石墨电极移动 |
| D.电路上通过0.5 mol电子,可制得0.5 mol Cu2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钢铁表面发生吸氧腐蚀时,钢铁表面水膜的pH增大 |
| B.电解精炼铜,开始通电一段时间后,阳极溶解的铜的质量比阴极析出的铜的质量少 |
| C.在镀件上电镀锌,用锌作阳极 |
| D.工作时在原电池的负极和电解池的阴极上都是发生失电子过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com