
| A. | 采取低碳、节俭的生活方式,深入农村和社区宣传环保知识 | |
| B. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 | |
| C. | 热纯碱可以去油污,明矾可以净化水,漂白粉可用于漂白织物 | |
| D. | 海水淡化的方法有蒸馏法、电渗析法等 |
分析 A.采取低碳、节俭的生活方式,深入农村和社区宣传环保知识,有利于节约能源,保护环境;
B.依据活性炭与次氯酸漂白原理解答;
C.碳酸钠水解生成氢氧化钠,明矾电离产生的铝离子水解生成氢氧化铝,氢氧化铝具有吸附性,次氯酸具有漂白性;
D.依据蒸馏、电渗法原理解答.
解答 解:A.采取低碳、节俭的生活方式,节省大量的能源,符合保护环境的措施,故A正确;
B.活性炭脱色是利用其吸附性,次氯酸盐漂白是利用次氯酸的强氧化性,故B错误;
C.纯碱为强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,油脂在碱性条件下能水解,明矾中含有铝离子,铝离子水解生成氢氧化铝胶体,胶体具有吸附性而净水;漂白粉具有强氧化性,利用其强氧化性漂白织物,故C正确;
D.海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),蒸馏是分离和提纯液态混合物常用的方法之一蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备;电渗析法是一种利用离子交换膜进行离子交换的方法,是近年发展起来的一种较好的海水淡化技术,原理为通电后,阴离子移向阳极,阳离子移向阴极,分离盐和水,故D正确;
故选:B.
点评 本题为综合题,考查了化学在社会生活、生产中的应用,熟悉相关物质的性质是解题关键,注意盐类水解规律、物质漂白原理,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应开始时的速率:甲<乙 | |
| B. | 反应所需时间:甲>乙 | |
| C. | 反应开始前,酸的物质的量浓度:甲=乙 | |
| D. | 若使两酸溶液PH都等于5,则加水的体积:甲=乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH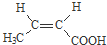 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | D、B简单离子半径大小关系为D3+>B2+ | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | 最高价氧化物对应的水化物的酸性:H2EO4>HFO4 | |
| D. | 气态氢化物的稳定性HG>HF>H2E |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol | |
| B. | 放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必大于amol | |
| C. | 放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4amol | |
| D. | 放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com