
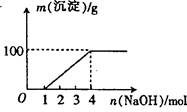
| A.②⑤⑥⑦ | B.②③⑤⑦ |
| C.①②③⑥⑦ | D.①②③④⑤⑦ |


科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2SO4溶液和BaCl2溶液 |
| B.铝片与Hg(NO3)2溶液 |
| C.稀硫酸与铜片 |
| D.NaNO3溶液与KCl溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
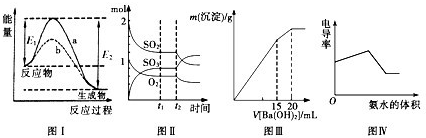
| A.图I表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是增加了SO2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是增加了SO2 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时铝离子恰好沉淀完全 |
| D.电导率可表示溶液导电性的强弱,电导率越大导电性越强。图Ⅳ可表示向盐酸和醋酸混合溶液中滴入氨水过程中电导率的变化关系 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定有SO2-4 | B.SO2-4、SO2-3或Ag+中至少有一种 |
| C.一定无Ag+ | D.可能有CO2-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3、HCl、 BaCl2 | B.BaCl2、HCl、Na2CO3 |
| C.Na2CO3、BaCl2、HCl | D.BaCl2、Na2CO3、HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该固体粉末中一定不含有BaCl2 |
| B.该固体粉末中一定含有KNO3 |
| C.它的组成可能是CaCO3、BaCl2、CuSO4 |
| D.它的组成一定是CaCO3、Na2SO4、KNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com