
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度 (mL) | 滴定后的刻度 (mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
分析 (1)易潮解的药品,必须放在玻璃器皿上(如:小烧杯、表面皿)里称量;
(2)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂;
(3)中和滴定时,眼睛注视锥形瓶中溶液颜色变化,为便于观察溶液颜色变化,在锥形瓶下垫一张白纸;
(4)根据C(待测)═C(标准)×V(标准)÷V(待测)计算,V(标准)用两次的平均值;
根据m=CVM计算500mL溶液中氢氧化钠的质量,再根据质量分数公式计算氢氧化钠的质量分数;
(5)根据C(待测)═C(标准)×V(标准)÷V(待测)分析误差.
解答 解:(1)易潮解的药品,必须放在玻璃器皿上(如:小烧杯、表面皿)里称量,防止玷污托盘,因烧碱易潮解,所以应放在小烧杯中称量;
故答案为:A;
(2)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂;
故答案为:B;
(3)中和滴定时,眼睛注视锥形瓶中溶液颜色变化,为便于观察溶液颜色变化,在锥形瓶下垫一张白纸,
故答案为:眼睛注视锥形瓶中溶液颜色变化;便于观察溶液颜色变化;
(4)V(标准)=[(20.50-0.40)+(24.00-4.10)]mL÷2=20.00mL,
C(待测)═$\frac{c标•V标}{V待测}$=$\frac{0.2000mol•{L}^{-1}×0.02L}{0.01L}$═0.4000mol•L-1,
m(烧碱)═CVM═0.4000mol•L-1×0.5L×40g/mol═8.0g
ω═$\frac{8.0g}{8.2g}$×100%═97.56%,
故答案为:0.4000;97.56%;
(5)①开始俯视,滴定终点平视,导致计算出的标准液体积偏大,浓度偏高,
故答案为:偏高;
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,导致待测液的物质的量增加,消耗的标准液体积增大,结果偏高;
故答案为:偏高.
点评 本题考查了酸碱中和滴定中的操作要点、中滴定的计算以及误差分析,题目难度不大,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
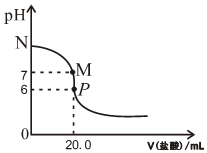 298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.
298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 | |
| B. | 步骤①中当溶液呈现深黄色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O 达到平衡状态 | |
| C. | 步骤②中,若要还原1 mol Cr2O${\;}_{7}^{2-}$离子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| B. | 向1 L0.2 mol•L-1 HF溶液中加入1 L 0.2 mol•L-1 CaCl2溶液,没有沉淀产生 | |
| C. | AgCl不溶于水,不能转化为AgI | |
| D. | 常温AgCl若在NaI溶液中开始转化为AgI,NaI浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH固体称量时间过长 | B. | 盛放标准盐酸的滴定管用碱液润洗 | ||
| C. | 用酚酞作指示剂 | D. | 固体NaOH中含有Na2O杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
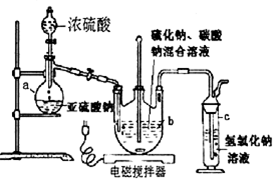
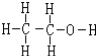 .
.| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
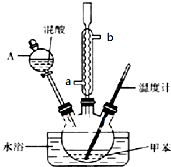 某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):
某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):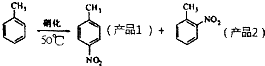
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 产品1 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 产品2 | 1.162 | 222 | 不溶于水,易溶于液体烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com