
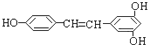
 )广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
)广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )| A、1mol,1mol |
| B、3.5mol,7mol |
| C、5mol,7mol |
| D、6mol,7mol |
科目:高中化学 来源: 题型:
| A、0.21 mol/L |
| B、0.42 mol/L |
| C、0.56 mol/L |
| D、0.24 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=2:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗 |
| B、用pH试纸测定溶液pH时,通常是将pH试纸放入待测溶液中润湿后,半分钟内跟标准比色卡比较 |
| C、重结晶是提纯固体的常用方法,碘单质亦可在水溶液中通过重结晶提纯 |
| D、用丁达尔现象可鉴别蛋白质溶液、淀粉溶液和葡萄糖溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| KMnO4(H+) |
| kmNo4(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫与氯气混合后漂白性将会减弱甚至消失 |
| B、蛋白质,油脂,纤维素是天然的高分子材料 |
| C、聚乙烯塑料制品可用于食品的包装 |
| D、次氯酸钠溶液可用于环境的消毒杀菌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com