
 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| ①Zn为正极,Cu为负极; ②H+向负极移动; ③Cu极有H2产生; ④电子流动方向Zn→G→Cu; ⑤正极的电极反应式是Zn-2e-=Zn2+: ⑥若有1mol电子流过导线,则理论上产生0.5mol H2. |
分析 Zn、Cu、稀硫酸构成原电池,锌易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,电子从负极沿导线流向正极,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,以此解答该题.
解答 解:(1)锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-═H2↑,由此可知若有1mol电子流经导线,则产生0.5mol氢气,电子由负极经外电路流向正极,原电池中阳离子向正极移动,阴离子向负极移动,则正确的有③④⑥,
故答案为:③④⑥;
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(3)锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气,
故答案为:锌失电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气;
(4)如果把硫酸换成硫酸铜溶液,正极Cu上会有铜单质析出,而变粗,其电极反应为:Cu2++2e-=Cu;则电池总反应为Zn与铜离子的反应,为Cu2++Zn=Zn2++Cu,
故答案为:铜极; Cu2++2e-=Cu.
点评 本题考查学生原电池的工作原理以及电极反应和电子转移之间的关系知识,注意把握原电池的构成条件、电极方程式的书写等基础知识的积累,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
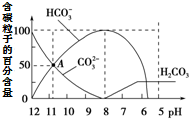 常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )| A. | 0.1 mol•L-1 Na2CO3溶液中:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+) | |
| B. | A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 0.05 mol•L-1 NaHCO3溶液的pH=8 | |
| D. | pH=7时混合液中c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 标准状况下,22.4L N2和H2的混合气中含NA个原子 | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,22.4L氨水含有NA个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:11 | B. | 16:9 | C. | 8:11 | D. | 32:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子种类不相同 | B. | c(OH-)前者大于后者 | ||
| C. | 均存在电离平衡和水解平衡 | D. | 分别加入NaOH固体,c(CO32-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
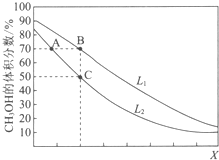 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )| A. | X代表压强 | B. | L1<L2 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R一定是非金属元素 | B. | R的最高价氧化物为R2O5 | ||
| C. | 最高价氧化物对应水化物H2RO4 | D. | R的气态氢化物为RH5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/LNaCl溶液含有nA个Na+ | |
| B. | 0.1molOH-含nA个电子 | |
| C. | 1molCu和足量稀硝酸反应产生nA个NO分子 | |
| D. | 常温常压下,22.4LCO2中含有nA个CO2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com