
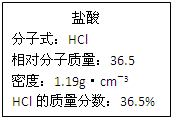
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据分析 (1)盐酸溶液中,溶液浓度、溶液密度都与溶液体积大小无关,而氯化氢的物质的量、氯离子数目与溶液体积大小有关;
(2)依据C=$\frac{1000ρω}{M}$计算盐酸的物质的量浓度;
(3)①根据配制一定物质的量浓度的溶液步骤选用仪器,结合容量瓶构造解答;
②根据操作方法对c=$\frac{n}{V}$的影响分析产生的误差;
③根据配制过程中溶质的物质的量不变计算出需要浓盐酸的体积;
(4)根据n(HCl)=n(NaOH)计算.
解答 (1)A.溶液中HCl的物质的量大小取决于溶液体积大小和溶液浓度,故A错误;
B.溶液具有均一性,溶液的浓度与溶液体积大小无关,故B正确;
C.溶液中Cl-的数目与溶液浓度、溶液体积大小及溶质化学式组成有关,故C错误;
D.溶液具有均一性,溶液的密度与溶液体积大小无关,故D正确;
故答案为:BD;
(2)该浓盐酸中HCl的物质的量浓度为$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L;
故答案为:11.9;
(3)①配制500mL物质的量浓度为0.3mol/L稀盐酸的步骤有:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,则使用的仪器有:量筒、烧杯、玻璃杯、500mL容量瓶、胶头滴管等,
还缺少的仪器有:500mL容量瓶;
容量瓶标有的内容有:温度、容积、刻度线;
故答案为:500mL容量瓶;ACE;
②a.定容时俯视容量瓶刻度线,导致溶液体积偏小,溶液浓度偏大;
b.溶液转移后未洗涤烧杯,导致溶质的物质的量偏小,溶液浓度偏小;
故答案为:偏大;偏小;
③配制500mL物质的量浓度为0.4mol•L-1的稀盐酸,设需要浓盐酸体积V,依据溶液稀释过程中溶质的物质的量不变得:500mL×0.4mol/L=11.9mol/L×V,
解得:V=16.8mL;
故答案为:16.8;
(4)n(HCl)=n(NaOH)=0.01mol,V(HCl)=$\frac{0.01mol}{0.400mol•{L}^{-1}}$=0.025L=25mL,
故答案为:25.
点评 本题考查物质的量浓度计算、一定物质的量浓度溶液配制等,明确配制原理及操作步骤是解题关键,难度不大,注意根据c=$\frac{n}{V}$理解溶液配制原理及进行误差分析.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应①是置换反应,HCl表现还原性 | |
| B. | 反应②是复分解反应,HCl表现氧化性 | |
| C. | 反应③中HCl既有氧化性也有还原性 | |
| D. | 反应①中氧化剂和氧化产物的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高的温度都难以分解 | |
| B. | 乙醇能和水以任意比例互溶 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性以此减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、C1-、NO3- | B. | K+、Ag+、C1-、NO3- | ||
| C. | H+、Na+、CO32-、SO42- | D. | H+、Fe2+、C1-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用50mL 12 mol•L-1的氯化氢水溶液与足量二氧化锰共热制取氯气 | |
| B. | 向100mL 3 mol•L-1的硝酸中加入5.6g铁 | |
| C. | 将1g铝片投入20mL 18.4 mol•L-1的硫酸中 | |
| D. | 常温常压下,0.1mol氯气通入1L水中反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com