
| A��Cl-��Br-��CrO42- | B��CrO42-��Br-��Cl- |
| C��Br-��Cl-��CrO42- | D��Br-��CrO42-��Cl- |
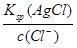 =
=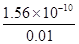 = 1.56��10-8
= 1.56��10-8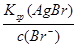 =
=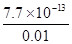 = 7.7��10-11
= 7.7��10-11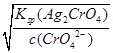 =
= =3.0��10-5
=3.0��10-5

 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 mMn+��aq�� + nAm����aq����Ksp��[c��Mn+��]m��[c��Am����]n��
mMn+��aq�� + nAm����aq����Ksp��[c��Mn+��]m��[c��Am����]n���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���÷�Ӧ��ƽ��ʱc(Mn2+)��c(Cu2��) |
| B��MnS��Ksp��CuS��Ksp�� |
| C����ƽ����ϵ�м�������CuSO4�����c(Mn2+)��� |
D���÷�Ӧ��ƽ�ⳣ��K��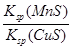 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
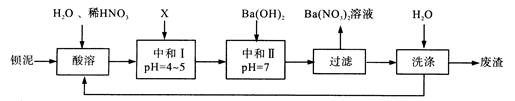
| A��BaCl2 | B��Ba(OH)2 | C��Ba(NO3)2 | D��BaCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��298Kʱ��CaSO4���ܽ��ԼΪ7.00��10��2 mol/L |
| B����ӦCaSO4(s) + CO32��= CaCO3(s) + SO42����298Kʱ��ƽ�ⳣ��K= Ksp(CaSO4) / Ksp(CaCO3) = 1.75��104 |
| C��CaCO3��CaSO4�ı�����Һ�ĵ��������������������Ƕ���������� |
| D�������¶ȣ������ε��ܶȻ����ܽ�ȶ����ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Ca(OH)2(aq)
Ca(OH)2(aq)  Ca2+(aq)+2OH-(aq)�����������Һ�м���������ʯ��ʱ������˵����ȷ����( )
Ca2+(aq)+2OH-(aq)�����������Һ�м���������ʯ��ʱ������˵����ȷ����( )| A��n(Ca2+)���� | B��c(Ca2+)���� | C��n(OH-)���� | D��c(OH-)��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2Ag+(aq)+ S2-(aq)����Ksp=____________��
2Ag+(aq)+ S2-(aq)����Ksp=____________��| A����ϡ����ϴ��AgCl��������ˮϴ�����AgClС�� |
| B�����ʵ��ܽ�����¶ȵ����߶����ӣ������ʵ��ܽⶼ�����ȵģ� |
C������Al(OH)3(s)  Al(OH)3(aq) Al(OH)3(aq)  Al3+��3OH-��ǰ��Ϊ�ܽ�ƽ�⣬����Ϊ����ƽ�⣻ Al3+��3OH-��ǰ��Ϊ�ܽ�ƽ�⣬����Ϊ����ƽ�⣻ |
| D������Һ�е�Mg2+����OH-����Mg2+����CO32-Ч���ã�˵��Mg(OH)2���ܽ�ȱ�MgCO3�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com