
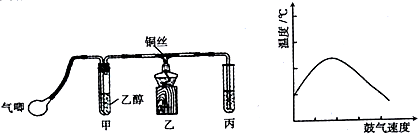
分析 由乙醇的催化氧化实验装置可知,气球中气体将乙醇赶入试管中,且氧气、乙醇在Cu作催化剂条件下发生反应生成乙醛.
(1)乙醛中含-CHO,可发生银镜反应、与新制氢氧化铜悬浊液生成砖红色沉淀;
(2)乙醇中含-OH,能发生催化氧化生成乙醛;
(3)水浴加热可以让乙醇在一定的温度下成为蒸气,从而加快反应的速率;丙中液体可倒吸进入试管中;
(4)根据鼓气的速度和反应体系温度之间的关系来回答;
(5)乙醇和乙醛为互溶的液体,可根据它们的沸点不同进行分离;
(6)若是乙醛被氧化,则有乙酸和溴化氢生成,溶液呈强酸性;若是发生加成反应,则生成饱和含溴有机物,溶液酸性减弱,故可利用酸碱指示剂来确定合理.
解答 解:(1)乙醛中含-CHO,可发生银镜反应、与新制氢氧化铜悬浊液生成砖红色沉淀,而B、D中物质与乙醛不反应,则检验试剂为AC,
故答案为:AC;
(2)乙醇可以被催化氧化生成醛和水,反应的方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(3)将甲装置浸在70℃~80℃的水浴中,使生成乙醇蒸气的速率加快且较均匀,导气管直接插入丙溶液内,生成的乙醛和过量的乙醇易溶于水,则设计上的缺陷导致丙装置产生倒吸现象,
故答案为:使生成乙醇蒸气的速率加快且较均匀;发生倒吸;
(4)反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,但是过量的气体会将体系中的热量带走,所以后阶段温度降低,
故答案为:过量的气体将体系中的热量带走;
(5)乙醇和乙醛都为有机物,两者为互溶的液体,可根据沸点不同用蒸馏的方法进行分离,
故答案为:蒸馏;
(6)溴水呈酸性,乙醛具有还原性,乙醛被溴水氧化生成乙酸和HBr,溶液酸性增强,乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应,没有HBr生成,消耗溴酸性减弱,所以检验褪色后溶液的酸碱性变化,确定其发生哪类反应,
故答案为:合理,若酸性明显增强,则猜想①正确;若酸性明显减弱,则猜想②正确.
点评 本题考查性质实验方案的设计,为高频考点,把握乙醇的性质及实验装置的作用、反应原理为解答的关键,注意(6)中实验设计与产物性质有关,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子电子层数比B原子电子层数多 | |
| C. | 1mol A从酸中置换 H+生成的H2比 1mol B从酸中置换H+生成的H2多 | |
| D. | A金属可以把B金属从其盐溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
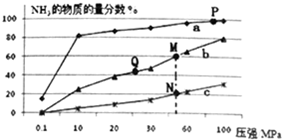 已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.
已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
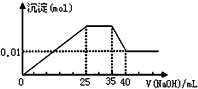 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:| A. | 原溶液一定不存在H+、Cu2+、CO32-、Fe3+ | |
| B. | 不能确定原溶液是否含有K+、NO3- | |
| C. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH的浓度为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性,因而可以使石蕊试液褪色 | |
| B. | 大气中SO2的主要来源是汽车排出的尾气 | |
| C. | SO2是硫酸的酸酐 | |
| D. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:H+、Al3+、NO3-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
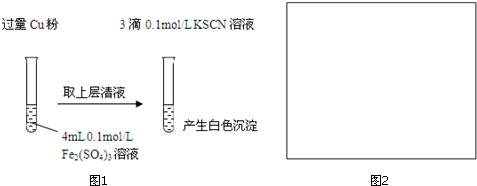
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| :步骤2:取取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 无明显现象 |
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com