
分析 常温常压下几种气态烷烃,所以碳原子数小于等于4,在标准状况下密度为1.34g/L,平均摩尔质量为:1.34g/L×22.4L/mol=30g/mol,所以一定有甲烷,乙烷的相对分子量为30,一氯取代产物只有一种,而丙烷的一氯代物是两种,丁烷(无支链)的一氯代物也是两种,而题意中混合烷烃和氯气在光照下反应生成的一氯取代产物共有5种,由此分析解答.
解答 解:常温常压下几种气态烷烃,所以碳原子数小于等于4,在标准状况下密度为1.34g/L,平均摩尔质量为:1.34g/L×22.4L/mol=30g/mol,所以一定有甲烷,乙烷的相对分子量为30,一氯取代产物只有一种,而丙烷的一氯代物是两种,丁烷(无支链)的一氯代物也是两种,而题意中混合烷烃和氯气在光照下反应生成的一氯取代产物共有5种,所以是甲烷、丙烷和丁烷的混合气体,故答案为:甲烷、丙烷和丁烷.
点评 该题是中等难度的试题,也是高考种的常见考点之一,试题基础性强,贴近高考,注重解题方法的指导与训练,有助于培养学生的逻辑推理能力和逆向思维能力,提高学生分析问题、解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
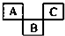 如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.
如图是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等. ;B的最高价氧化物对应的水化物的化学式为H2SO4.
;B的最高价氧化物对应的水化物的化学式为H2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属 | 冶炼方法 | |
| A | 钾、钙 | Ⅳ |
| B | 钠、铝 | Ⅲ |
| C | 铜、铁 | Ⅰ |
| D | 银、汞 | Ⅱ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将40 g NaOH溶解于1 L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4 L HCl 气体溶于水配成1 L的盐酸溶液 | |
| C. | 将1 L 10 mol/L的浓盐酸与水混合配成10 L溶液 | |
| D. | 从1000 mL 1 mol/L NaCl溶液中取出100 mL的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol•L-1 | B. | 0.10mol•L-1 | C. | 0.30mol•L-1 | D. | 0.50mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等浓度的盐酸和硫酸分别与等质量的碳酸氢钠粉末反应 | |
| B. | 等质量的锌粒分别与等体积、等浓度的盐酸和硝酸反应 | |
| C. | 等体积、等浓度的盐酸和硝酸分别与等质量的碳酸钠粉末反应 | |
| D. | 等体积的0.2mol•L-1盐酸和0.1mol•L-1硫酸分别与同种石灰石反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com