
| A. | 与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |
| B. | 与氧气的燃烧反应:2CH3CH2OH+O2$\stackrel{点燃}{→}$2CH3CHO+2H2O | |
| C. | 与氧气的催化氧化:CH3CH2OH+3O2$→_{△}^{Cu或Ag}$2CO2+3H2O | |
| D. | 与乙酸的酯化反应:CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3CH2OCH2CH3 |
分析 A.乙醇与钠反应生成乙醇钠和氢气;
B.乙醇燃烧生成二氧化碳和水;
C.乙醇催化氧化生成乙醛和水;
D.乙醇与乙酸发生酯化反应生成乙酸乙酯和水.
解答 解:A.乙醇与钠反应生成乙醇钠和氢气,方程式:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,故A正确;
B.乙醇燃烧生成二氧化碳和水,方程式:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O,故B错误;
C.乙醇催化氧化生成乙醛和水,方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,故C错误;
D.乙醇与乙酸发生酯化反应生成乙酸乙酯和水,方程式:CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3CO0CH2CH3+H2O,故D错误;
故选:A.
点评 本题考查了有机反应化学方程式的书写,明确乙醇的性质及发生的化学反应实质是解题关键,题目难度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:多选题
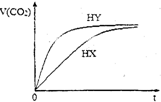 25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )
25℃时,将浓度均为0.1mol•L-1HX溶液和HY溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:下列说法正确的是( )| A. | 相同浓度的HX和HY溶液中水的电离程度:HX>HY | |
| B. | 相同体积相同浓度的HX和HY溶液中阴离子数目前者大于后者 | |
| C. | 向10mL 0.1mol•L-1的Na2CO3溶液中缓慢滴加10mL0.1mol•L-1的HY,混合后的离子浓度大小关系: c (Na+)>c (Y-)>c(HCO3-)>c (OH-)>c(H+) | |
| D. | 将等体积等浓度的HX和HY溶液分别用相同浓度的氢氧化钠溶液滴定,至中性时,消耗的氢氧化钠溶液体积前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等浓度时,若溶液中c(X-)=c(Y-)+c(HY),则乙的pH大 | |
| B. | 等浓度时,若甲的pH大,则甲中总离子浓度大 | |
| C. | 甲浓度大时,若溶液中c(X-)=c(Y-),则甲中水的电离程度大 | |
| D. | 乙浓度大时,若酸性HX强,则乙的水解程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10min内,Y的平均反应速率为0.03 mol•L-1•min-1 | |
| B. | 第10min时,X的反应速率为0.01 mol•L-1•min-1 | |
| C. | 10min内,消耗0.1 mol X,生成0.4 mol Z | |
| D. | 10min内,X和Y反应放出的热量为a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
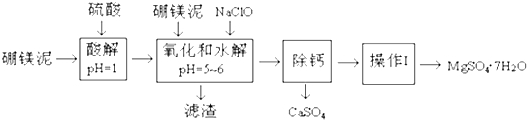
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com