
| A. | SO2→H2SO3 | B. | SiO2→H2SiO3 | C. | SO2→S | D. | S→SO3 |
分析 A.二氧化硫和水反应生成亚硫酸;
B.二氧化硅属于酸性氧化物,但不能和水反应;
C.二氧化硫能和硫化氢发生氧化还原反应生成S;
D.S不能一步被氧化生成三氧化硫.
解答 解:A.二氧化硫是可溶性的酸性氧化物,能和水反应生成亚硫酸,故A不选;
B.SiO2是不溶于水的酸性氧化物,所以不能一步实现生成H2SiO3 ,应该先和NaOH反应生成可溶性的硅酸钠,硅酸钠再和稀盐酸反应生成硅酸,故B选;
C.二氧化硫和硫化氢发生氧化还原反应生成S单质和水,所以能一步实现,故C不选;
D.S燃烧生成二氧化硫,二氧化硫在催化剂、加热条件下被氧气氧化生成三氧化硫,所以不能一步实现,故D选;
故选BD.
点评 本题考查元素化合物之间的转化,为高频考点,明确元素化合物性质及物质之间的转化是解本题关键,注意二氧化硅不能溶于水、S不能一步转化为三氧化硫,这些都是易错点.


科目:高中化学 来源: 题型:选择题
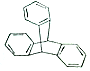 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )| A. | 分子式为C20H14 | B. | 属于苯的同系物 | ||
| C. | 能与溴水发生加成反应 | D. | 分子中所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤ | C. | ②③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)2、Fe(OH)3;Fe3O4 | B. | Fe(OH)2;FeO | ||
| C. | Fe(OH)2、Fe(OH)3;Fe2O3 | D. | Fe2O3;Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO${\;}_{3}^{2-}$+H2O | |
| B. | 向澄清石灰水中通入过量CO2;Ca2++2OH-+CO2=CaCO3↓++H2O | |
| C. | 硫酸氢钠溶液中加入过量氢氧化钡溶液:2HSO${\;}_{4}^{-}$+2Ba2++2OH-=2BaSO4↓+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量石灰水:Ca2++OH-+HCO${\;}_{3}^{-}$=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$ | B. | $\frac{1}{3}$ | C. | $\frac{1}{4}$ | D. | $\frac{1}{5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 1mol乙烯分子中含有共用电子对数为6NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,2.24LCl2溶于水达到饱和,可得到HClO分子的数目是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
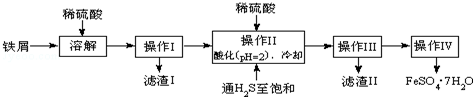
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com