
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>X>Y | |
| C. | 工业上可通过电解Y的盐溶液来制备Y的单质 | |
| D. | 氧元素分别与X、Y、Z形成的化合物都不止一种 |
分析 X、Y、Z为原子序数依次增大的短周期元素,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,则X的内层电子数为2,Z的最外层电子数为6,Y的最外层电子数为2,原子的最外层电子数之和为13,则X的最外层电子数为13-6-2=5,所以X为N、Y为Mg、Z为S,结合元素周期律知识进行解答.
解答 解:X、Y、Z为原子序数依次增大的短周期元素,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,则X的内层电子数为2,Z的最外层电子数为6,Y的最外层电子数为2,原子的最外层电子数之和为13,则X的最外层电子数为13-6-2=5,所以X为N、Y为Mg、Z为S,
A.X为N、Y为Mg、Z为S,电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越小,则原子半径大小为:Y>Z>X,故A错误;
B.X为N、Y为Mg、Z为S,N的非金属性最强,S的其次,Mg的最小,则最高价氧化物对应水化物的酸性:X>Z>Y,故B错误;
C.Y为Mg,工业上通过电解熔融氯化镁获得氯气和金属镁,故C正确;
D.氧元素与Mg反应生成的产物只有MgO一种,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,利用原子结构来推断元素是解答本题的关键,注意明确短周期元素的内层电子只能为2或8,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 无色澄清透明溶液中:K+、H+、Cl-、MnO4- | |
| B. | 在pH=1的溶液中:$N{H_4}^+$、K+、ClO-、Cl-、 | |
| C. | 含大量Fe3+的溶液:$N{H_4}^+$、Na+、Cl- | |
| D. | 与铝反应能产生氢气的溶液:K+、Al3+、Cl-、$S{O_4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 过量的氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | |
| C. | 醋酸溶液中加入少量氢氧化钠:H++OH-═H2O | |
| D. | NaHCO3溶液与过量Ba(OH)2溶液混合:2HCO3-+2OH-+Ba2+═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质A的转化率增大了 | B. | 平衡向正反应方向移动 | ||
| C. | 物质C的体积分数增大了 | D. | a+b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量 | B. | 密度 | C. | 分子总数 | D. | 质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
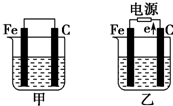 如图所示,甲、乙是电化学实验装置,请回答下列问题:
如图所示,甲、乙是电化学实验装置,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com