
| A. | Q2=2 Q1 | B. | 2Q1<Q2 | C. | Q1<Q2<92.4 kJ | D. | Q1=Q2<92.4 kJ |
分析 热化学方程式A2(g)+3B2(g)?2AB3(g)(每生成2mol AB3放出92.4kJ的热量),表示一定条件下,1molA2(g)与3molB2(g)反应生成2molAB3(g)放出的热量是92.4kJ.恒温恒压下,反应前后气体的物质的量发生变化,①与②中n(A2):n(B2)=1:3,二者为等效平衡,反应物的转化率相同,②中参加反应的量是①中的2倍,据此判断.
解答 解:热化学方程式A2(g)+3B2(g)?2AB3(g)(每生成2mol AB3放出92.4kJ的热量),表示一定条件下,1molA2(g)与3molB2(g)反应生成2molAB3(g)放出的热量是92.4kJ,反应为可逆反应,物质不能完全反应,恒温恒压下,反应前后气体的物质的量发生变化,①与②中n(A2):n(B2)=1:3,二者为等效平衡,反应物的转化率相同,②中参加反应的量是①中的2倍,所以Q2=2 Q1<184.8 kJ.
故选:A.
点评 考查热化学方程式的意义、反应热的计算、可逆反应特征、等效平衡等,难度中等,注意掌握等效平衡规律、理解热化学方程式意义.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO、SiO2都是酸性氧化物 | |
| B. | PM2.5是指大气中直径接近于2.5xl0 -6m的颗粒物,它在空气中形成气溶胶 | |
| C. | 向蛋白质溶液中滴加CuS04溶液产生沉淀属于化学变化 | |
| D. | KCl和SO3溶于水后均能导电,是因为KC1和S03都为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 硫酸铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法分离CaCO3和CaCl2溶液的混合物 | |
| B. | 用结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| C. | 用蒸馏法分离乙醇和水的混合物 | |
| D. | 用加热法分离碘和氯化铵的混合物(提示:碘易升华,氯化铵受热易分解.冷却后它们都又重新生成固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
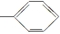 ⑤-CHO ⑥-H.
⑤-CHO ⑥-H.| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
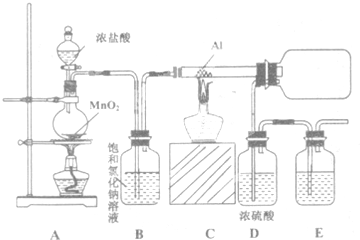
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com