
| A. | 反应达到平衡状态时A的转化率为60% | |
| B. | x=4 | |
| C. | 反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6:5 | |
| D. | 若混合气体的密度不再变化,则该可逆反应达到化学平衡状态 |
分析 经5s反应达平衡,在此5s内C的平均反应速率为0.2mol•L-1•s-1,可知生成C为0.2mol•L-1•s-1×2L×5s=2mol,同时生成1mol D,则$\frac{x}{2}$=$\frac{2mol}{1mol}$,解得x=4,则
3A(g)+B(s)?4C(g)+2D(g)
开始 2.5 2.5 0 0
转化 1.5 0.5 2 1
平衡 1 1.5 2 1
结合转化率=$\frac{转化的量}{开始的量}$×100%及物质的量比等于压强比计算.
解答 解:经5s反应达平衡,在此5s内C的平均反应速率为0.2mol•L-1•s-1,可知生成C为0.2mol•L-1•s-1×2L×5s=2mol,同时生成1mol D,则$\frac{x}{2}$=$\frac{2mol}{1mol}$,解得x=4,则
3A(g)+B(s)?4C(g)+2D(g)
开始 2.5 2.5 0 0
转化 1.5 0.5 2 1
平衡 1 1.5 2 1
A.反应达到平衡状态时A的转化率为$\frac{1.5}{2.5}$×100%=60%,故A正确;
B.由上述分析可知,x=4,故B正确;
C.反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为$\frac{2+1+2.5}{2.5}$=11:5,故C错误;
D.B为固体,气体的质量为变量,体积不变,则混合气体的密度不再变化,则该可逆反应达到化学平衡状态,故D正确;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、压强比及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意B为固体及反应中物质的量关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 放电时Cl-由负极向正极迁移 | |
| B. | 正极反应式为:AgCl+e-=Ag+Cl- | |
| C. | Mg作电池负极,发生氧化反应 | |
| D. | 当负极质量减轻4.8g,电路中通过0.4mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
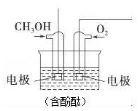 将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:
将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它在周期表的第5周期,第IA族 | |
| B. | 氢氧化铷是弱碱,是一种离子化合物 | |
| C. | 铷的一种核素${\;}_{37}^{86}$Rb原子核内的中子数与电子数之差49 | |
| D. | 在钠、钾、铷三种单质中,铷的熔点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱 和Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生 变性 |
| B | 在CuSO4溶液中加入KI溶液,再 加入苯,振荡后静置 | 有白色沉淀生成,苯层 呈紫红色 | 白色沉淀可能 为CuI |
| C | 将气体X通入品红溶液中 | 红色褪去 | X一定是SO2 |
| D | 将Fe(NO3)2样品溶于稀H2SO4后, 滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2样品 已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该电池常温下可稳定工作 | |
| B. | 放电时,电能转变为化学能 | |
| C. | 充电时,阳极发生反应:4OH--4e-═2H2O+O2↑ | |
| D. | 放电时,负极室发生反应:Fe+xH2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeOx+xH2,负极发生反应:H2+O2--2e-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的稳定性强于H2S | |
| B. | Cl元素最高正价为+7,而S元素最高正价为+6 | |
| C. | 将Cl2通入Na2S溶液中,产生黄色沉淀 | |
| D. | 单质与H2化合所需的反应条件,S比Cl2苛刻 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com