
| A. | 钢铁生锈,负极反应式为:Fe-3e-=Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++4OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O |
分析 A.负极Fe失去电子生成亚铁离子;
B.用石墨做电极电解硫酸铜溶液,生成Cu、氧气、硫酸;
C.Na2CO3溶液滴加酚酞,溶液变红,发生水解,水解反应以第一步为主;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:A.钢铁生锈,负极反应式为Fe-2e-=Fe2+,故A错误;
B.用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,故B错误;
C.Na2CO3溶液滴加酚酞,溶液变红,水解离子反应为CO32-+H2O?HCO3-+OH-,故C错误;
D.酸性高锰酸钾溶液中加入草酸钠,溶液褪色的离子反应为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重电极反应、电解与水解反应、氧化还原反应的离子反应考查,综合性较强,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
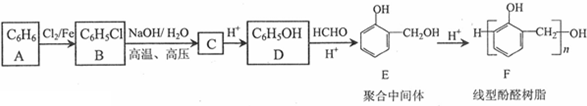
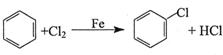 ,反应类型为取代反应
,反应类型为取代反应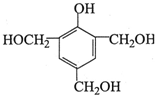
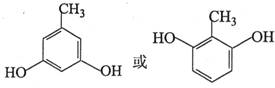 (写出其中一种的结构简式);
(写出其中一种的结构简式);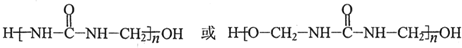 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+)>10-7mol/L | |
| B. | c(Al3+)=c(NH4+)+c(NH3•H2O) | |
| C. | Ca2+、HCO3-、Na+、Cl-能在该溶液中大量共存 | |
| D. | 向该溶液中滴加10mL0.1mol/L NaOH溶液,无沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH2.H2O | |
| B. | 高锰酸钾酸性溶液吸收二氧化硫:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ | |
| C. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气象环境报告中的“PM2.5”是一种新分子的描述 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量、 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 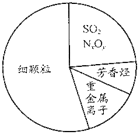 如图为雾霾的主要成分示意图,SO2和NxOy都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
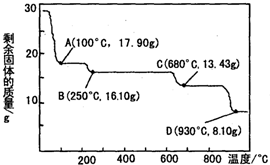 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3•H2O?NH4++OH- | K=1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多氯代甲烷中分子结构为正四面体的是CH2Cl2 | |
| B. | 氯代甲烷在常温下均为液体 | |
| C. | 乙烯可用于制取1,2-二氯乙烷和乙醇,前者为加成反应,后者为水解反应 | |
| D. | 麻醉剂三氟氯溴乙烷(CF3CHClBr)的同分异构体有3种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
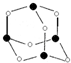 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.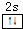 ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.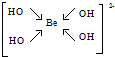 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com