
分析 弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子;
单质,混合物既不是电解质也不是非电解质,根据定义即可解答.
解答 解:①铁片为单质,既不是电解质也不是非电解质;②NaNO3 在水溶液中或熔融状态下完全电离,属于强电解质;④FeCl3在水溶液中或熔融状态下完全电离,属于强电解质,
③NH3•H2O在水溶液中不能完全电离,NH3•H2O?NH4++OH-,NH3•H2O是弱碱,是弱电解质,⑥H2SO3在水溶液中不完全电离,是弱电解质,
⑤酒精为共价化合物,溶于水溶质只存在酒精分子不导电,属于非电解质; ⑦SO2的水溶液虽能导电,但不能自身电离出离子,是二氧化硫和水反应生成的亚硫酸电离出的离子所致,所以二氧化硫属于非电解质;
故答案为:③⑥;⑤⑦.
点评 本题考查弱电解质、非电解质的判别,题目难度不大,注意掌握强弱电解质、电解质与非电解质的概念,注意不要漏选.


科目:高中化学 来源: 题型:填空题
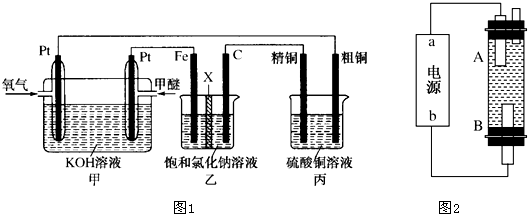
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
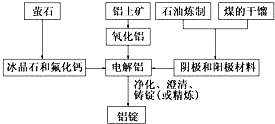 如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:
如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO | C. | CH4 | D. | 煤气(CO和H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
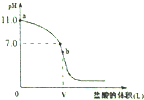 常温时,向浓度为0.1mol/L体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而变化的滴定曲线如图所示,b点表示两种溶液恰好完全反应.
常温时,向浓度为0.1mol/L体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而变化的滴定曲线如图所示,b点表示两种溶液恰好完全反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com